1、填空题 氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有 性,请写出工业上用氯气与NaOH溶液反应生产消毒剂NaClO的离子方程式 。
(2)棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O和NaHCO3的离子方程式 。
(3)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为 。
②ClO2遇浓盐酸会生成Cl2,每生成1 mol Cl2转移电子的物质的量为 。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为 。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:①上述反应中,4 mol HCl被氧化放出115.6 kJ的热量。

则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
参考答案:(1)强氧化 Cl2+2OH- ClO-+Cl-+H2O
ClO-+Cl-+H2O
(2)2Cl2+2C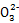 +H2O
+H2O 2HC
2HC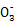 +2Cl-+Cl2O
+2Cl-+Cl2O
(3)①2Cl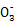 +SO2
+SO2 S
S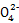 +2ClO2 ②1.6 mol ③2∶5
+2ClO2 ②1.6 mol ③2∶5
(4)31.9 强
本题解析:(2)依据信息可知Cl2+C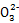
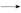 HC
HC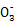 +Cl-+Cl2O,依据化合价守恒可知Cl2+C
+Cl-+Cl2O,依据化合价守恒可知Cl2+C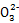
 HC
HC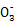 +2Cl-+Cl2O,配平除“H”、“O”之外的其他原子可得2Cl2+2C
+2Cl-+Cl2O,配平除“H”、“O”之外的其他原子可得2Cl2+2C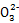
 2HC
2HC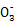 +2Cl-+Cl2O,补“H2O”配“H”得2Cl2+2C
+2Cl-+Cl2O,补“H2O”配“H”得2Cl2+2C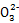 +H2O
+H2O 2HC
2HC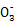 +2Cl-+Cl2O,最后用“O”检查;(3)②依据化学方程式2ClO2+8HCl(浓)
+2Cl-+Cl2O,最后用“O”检查;(3)②依据化学方程式2ClO2+8HCl(浓) 5Cl2↑+4H2O可知每生成5 mol Cl2转移8 mol电子;③氧化剂ClO2中氯元素的化合价降低5价,还原剂Mn的化合价升高2价,所以氧化剂与还原剂的物质的量之比为2∶5;(4)设断开1 mol H—O键与断开1 mol H—Cl 键所需能量分别为x、y,形成化学键放出的能量(4x+2×243 kJ)减断开化学键吸收的能量(4y+498 kJ)等于115.6 kJ,可得x-y="31.9" kJ
5Cl2↑+4H2O可知每生成5 mol Cl2转移8 mol电子;③氧化剂ClO2中氯元素的化合价降低5价,还原剂Mn的化合价升高2价,所以氧化剂与还原剂的物质的量之比为2∶5;(4)设断开1 mol H—O键与断开1 mol H—Cl 键所需能量分别为x、y,形成化学键放出的能量(4x+2×243 kJ)减断开化学键吸收的能量(4y+498 kJ)等于115.6 kJ,可得x-y="31.9" kJ
本题难度:困难
2、填空题 (16分)NH3能被O2氧化生成NO,进而氧化成NO2,用来制造硝酸;将NO2(g)转化为N2O4(l),再制备浓硝酸。
(1)2NO(g)+ O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。

①P1______(填“>”或“<”)P2
②随温度升高,该反应平衡常数变化的趋势是____________。
(2)已2NO2(g) N2O4(g) △H1<0
N2O4(g) △H1<0
2NO2(g) N2O4(l) △H2<0
N2O4(l) △H2<0
下列能量变化示意图中,正确的是_______(填序号)

(3)50℃时在容积为1.0L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
①50℃时,体系中各物质浓度随时间变化如图所示。在0~60s 时段,反应速率v(NO2)为_________mol/(L·s)。
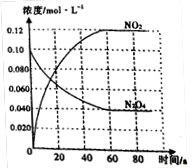
②T______(填“>”或“<”) 50℃。
③计算温度T时该反应的平衡常数K(写出计算过程)。
(4)科学家正在开发以氨代替氢气的新型燃料电池有许多优点;制氨工业基础好、技术成熟、成本低、储运方便等。直接供氨式碱性(KOH)燃料电池的总反应为:4NH3+3O2==2N2+6H2O,氨气应通入_______(填“正极”或“负极”)室,正极反应式为_____________________________
参考答案:(1)① <(1分) ②逐渐减小(1分) (2)A(2分)
(3)① 0.0020(2分) ②>(2分)
③反应达平衡时N2O4的浓度减少0.0020 mol/(L·s) ×10s=0.020 mol/L(1分)
N2O4(g)  2NO2(g)
2NO2(g)
c开始(mol/L) 0.040 0.12
c平衡(mol/L) (0.040-0.020)(0.12+0.020×2)(2分)
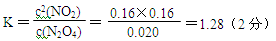
(4)负极(1分) 3O2+ 6H2O + 12e-=12OH-(2分)
本题解析:(1)①反应是气体体积减少的反应,温度相同时压强越大,平衡向正向移动,NO的转化率就越大,P2下的转化率比P1大,故P2较大,则P1<P2,②压强相等时,温度升高NO的转化率减小。故升高温度平衡向逆向移动,平衡常数减小。(2)反应的△H<0,所以反应是放热反应,NO2的能量较高,同种物质气态的能量比液态高,故A对。(3)①从图看出0~60s 时段,NO2的浓度改变了0.12mol/L,则NO2反应速率为:0.12mol/L÷60s=" 0.0020" mol/(L·s)。 ②2NO2(g) N2O4(g) △H<0则N2O4(g)
N2O4(g) △H<0则N2O4(g) 2NO2(g),是吸热反应,改变温度后NO2(g)的浓度增大,故平衡向正向移动,所以是升高温度,则T>50℃。③反应达平衡时N2O4的浓度减少0.0020mol/(L·s) ×10s=0.020mol/L(1分)
2NO2(g),是吸热反应,改变温度后NO2(g)的浓度增大,故平衡向正向移动,所以是升高温度,则T>50℃。③反应达平衡时N2O4的浓度减少0.0020mol/(L·s) ×10s=0.020mol/L(1分)
N2O4(g)  2NO2(g)
2NO2(g)
c开始(mol/L) 0.040 0.12
c平衡(mol/L) (0.040-0.020)(0.12+0.020×2)(2分)
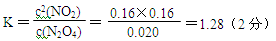
(4)从反应方程式看出N 的化合价升高,失去电子,故在负极反应;NH3在负极反应,那么O2在正极反应,电解质溶液是碱性的,电极反应为:3O2+ 6H2O + 12e-=12OH-(2分)
考点:化学平衡图像、化学平衡的移动、化学平衡常数的计算、燃料电池的工作原理。
本题难度:困难
3、填空题 (12分)(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);ΔH1=-Q1 kJ/mol,C2H5OH(g)=C2H5OH
(l);ΔH2=-Q2 kJ/mol,H2O(g)=H2O(l);ΔH3=-Q3 kJ/mol。若使23g液态无水酒精完全
燃烧,并恢复到室温,则整个过程中放出的热量为 ________________ kJ。
(2)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内
熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:

①右图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,请写出表示丙烷燃烧热的热化学方程式 。
②近年来已经研制出丙烷燃料电池,该电池的电解质溶液为KOH溶液,写出该电池负极的电极反应式:__________________________________________。
③某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出 3360ml(标准状况)氧气体,阴极析出金属 10.4 g,在该含氧酸盐中金属的化合价为 ____ ,在该实验中,若不考虑能量的损失,电池中消耗丙烷的质量最少是 __ g(结果精确至0.01 g)。
参考答案:
本题解析:
本题难度:困难
4、选择题 已知25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、
890.3 kJ·mol-1、2 800 kJ·mol-1,则热化学方程式正确的是
[? ]
A.C(s)+1/2O2(g)====CO(g) ΔH=-393.5 kJ·mol-1
B.2H2(g)+O2(g)====2H2O(g) ΔH=+571.6 kJ·mol-1
C.CH4(g)+2O2(g)====2H2O(g)+CO2(g) ΔH=-890.3 kJ·mol-1
D.1/2C6H12O6(s)+3O2(g)====3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
参考答案:D
本题解析:
本题难度:简单
5、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:
CH3OH(g) + H2O(g) → CO2(g) + 3H2(g)
参考答案:
本题解析:
本题难度:一般