1、选择题 下列热化学方程式中 ΔH的数值能表示可燃烧热的是
[? ]
A.H2(g) + Cl2(g) = 2HCl(g) ΔH =-184.6kJ/mol
B.CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) ΔH =-802.3kJ/mol
C.2H2(g) + O2(g) = 2H2O(l) ΔH =-571.6kJ/mol
D.CO(g) + 1/2O2(g) = CO2(g) ΔH =-283kJ/mol
参考答案:D
本题解析:
本题难度:简单
2、填空题 (14分)用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1 000 mL溶液。除烧杯外,还需要的玻璃仪器有___________、?、?_。
(2)滴定:
①盛装0.1000 mol·L-1盐酸标准液应该使用_______式滴定管。②滴定时双眼应?。
③有关数据记录如下:
测定序号
| 待测溶液的体积/mL
| 所耗盐酸标准液的体积/mL
|
滴定前
| 滴定后
|
1
| 20.00
| 0.50
| 20.78
|
2
| 20.00
| 1.20
| 21.32
|
(3)计算纯度:烧碱样品的纯度是_________________。
(4)误差讨论(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果___________;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果___________;
③读数时,滴定前仰视,滴定后俯视,则会使测定结果___________。
参考答案:(1)1 000 mL容量瓶、玻璃棒、胶头滴管?
(2)①酸?②注视锥形瓶中溶液颜色的变化?
(3)80.8%?(4) ①无影响? ②偏高? ③偏低
本题解析:(1)在配制溶液时,除烧杯外,还需要的玻璃仪器有1000 mL容量瓶、玻璃棒、胶头滴管。
(2)盐酸标准溶液应该使用酸式滴定管,滴定时眼睛注视锥形瓶中溶液颜色的变化。
(3)滴定过程中使用盐酸的体积为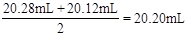 ,所以烧碱样品的纯度为
,所以烧碱样品的纯度为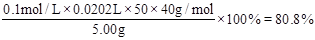 。
。
(4)根据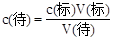 ,用蒸馏水冲洗锥形瓶,不影响标准液的用量,所以无影响;在滴定过程中不慎将数滴酸液滴在锥形瓶外,标准液的体积比正常值大,所以偏高;读数时,滴定前仰视,滴定后俯视,标准液的体积比正常值小,所以偏低。
,用蒸馏水冲洗锥形瓶,不影响标准液的用量,所以无影响;在滴定过程中不慎将数滴酸液滴在锥形瓶外,标准液的体积比正常值大,所以偏高;读数时,滴定前仰视,滴定后俯视,标准液的体积比正常值小,所以偏低。
点评:本题非常基础,主要考查酸碱中和滴定的基本操作和误差分析。
本题难度:一般
3、填空题 (4分)在温度T下,c(OH-)=0.1 mol·L-1的Ba(OH)2的PH值为11。
(1)该温度下,100ml水中含有OH-约有_?个。
(2)该温度下,在PH=8的Ba(OH)2溶液中加入PH=5的盐酸,欲使混合溶液pH=7,则Ba(OH)2溶液与所加盐酸的体积比为__? __
参考答案:(4分)(1)_? 10-7 NA?个(2)__2:9
本题解析:因为题目告诉PH=11,所以H+浓度应为10-11mol/L。根据溶液离子积的算法:KW=C(H+)×C(OH-)=10-11×10-1=10-12。
(1)该温度下,水是中性,OH-浓度等于H+浓度,根据上面算出的离子积可推知,C(OH-)=10-6,物质的量应为10-7,再根据N/NA=n,可得100ml水中含有OH-约有10-7 NA。
(2)溶液混合后PH=7,根据离子积常数,可判断该溶液应该是碱性溶液。设Ba(OH)2溶液体积为V1,盐酸溶液体积V2,再依据混合溶液PH值计算方法列出计算式:[C(OH-)×V1—C(H+)×V2]/(V1+V2)=10-5。由该计算式可得V1/V2=2/9
本题难度:简单
4、选择题 沼气是一种能源,它的主要成分是CH4。0.5mol CH4完全燃烧生成CO2和H2O 时,放出445KJ热量,则下列热化学方程式正确的是
时,放出445KJ热量,则下列热化学方程式正确的是
A:2 CH4 (g)+4O2(g)=2CO2(g) +4H2O(l) △H=+890KJ/mol
B:CH4 +2 O2=CO2+2H2O △H=-890KJ/mol
C:CH4 (g)+2O2(g)=CO2(g) +2H2O(l) △H=-890KJ/mol
D:1/2 CH4 (g)+O2( g)= 1/2CO2(g)
g)= 1/2CO2(g)  +H2O(l) △H=-890KJ/mol
+H2O(l) △H=-890KJ/mol
参考答案:C
本题解析:略
本题难度:一般
5、选择题 室温时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
A.若PH>7,则一定是C1V1=C2V2
B.在任何情况下都是C(Na+)+C(H+)=C(CH3COO-) +C(OH-)
C.当PH=7时,若V1=V2,一定是C2>C1
D.若V1=V2,C1=C2,则C(CH3COO-) +C(CH3COOH)=C(Na+)
参考答案:A
本题解析:若二者恰好中和,溶液呈碱性,若氢氧化钠过量,溶液仍呈碱性,A错误;无论溶液显何性,都有电荷守恒:c(Na+)+c(H+)=c(CH3COO-) +c(OH-),B正确;若PH=7,则一定醋酸过量,C正确;若V1=V2,c1=c2,即氢氧化钠与醋酸恰好中和生成醋酸钠,c(CH3COO-) +c(CH3COOH)=c(Na+)为物料守恒式,D正确。
点评:掌握酸碱混合后溶液酸碱性判断的方法。
本题难度:一般