1、选择题 常温下pH最小的是下列各项中的( )
A.pH=0的溶液
B.0.04 mol·L-1H2SO4
C.0.5 mol·L-1HCl
D.0.05 mol·L-1CH3COOH
2、选择题 已知HF比CH3COOH易电离。关于物质的量浓度、体积都相同的NaF溶液和CH3COONa溶液,下列说法正确的是(? )
A.两溶液相比较,NaF溶液中的离子总数较多
B.在相同条件下,两溶液的pH大小为: CH3COONa< NaF
C.NaF溶液中:c(H+)+c(HF)= c(OH-)+ c(F-)
D.CH3COONa溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
3、选择题 向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH =4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多;但当pH>13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO22-)。其平衡关系如下:
Cr3++3OH- Cr(OH)3
Cr(OH)3 CrO22- + H+ + H2O
CrO22- + H+ + H2O
(紫色)?(灰绿色) (亮绿色)
向0. 05mo1·L-1 Cr2(SO4)3溶液50mL中,加入1.0mol·L-1NaOH溶液50mL,充分反应后,溶液中可观察到的现象是?(lg2=0.3)?(?)
A.溶液为紫色
B.溶液中有灰绿色沉淀
C.溶液为亮绿色
D.无法判断
4、填空题 25℃时,某酸HA:Ka=1.0×10-7,已知:溶液的酸度AG=lg[c(H+)/c(OH-)]
(1)HA的电离方程式为?。
(2)0.1 mol·L-1HA溶液中,c(H+)=?,AG=?。
(3)保持25℃,下列方法能使HA溶液的电离度、溶液pH都增大的是?(填字母)
A.加水稀释? B.加少量盐NaA固体? C.加少量NaOH固体
5、选择题 水的电离过程为H2O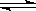 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是?(?)
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是?(?)
A.c(H+)随着温度升高而升高
B.35℃时,c(H+)>c(OH-)
C.水的电离度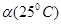 <
<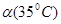
D.水的电离是吸热的