1、填空题 .(12分) 现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产
生下列离子(各种离子不重复)。
阳离子
| H+、Na+、A13+、Ag+、Ba2+
|
阴离子
| OH-、C1-、CO32-、NO3-、SO42-
|
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性;常温下,0.1 mol/L
B溶液的pH大于13,0.1 mol/L C溶液的pH等于1
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有
气体产生;(沉淀包括难溶物和微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)写出A、B、C、D、E的化学式:A、?B、?
C、?D、?E?
(2)写出A、E溶液反应的离子方程式:
?。
(3)写出B溶液与C溶液恰好完全反应的离子方程式:
?_____?。
(4)将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由小到大的顺序为(带两个单位电荷的离子不参与比较):__________________________________。
参考答案:(1)A、Na2CO3?B、Ba(OH)2?C、HCl D、 AgNO3?E、 Al2(SO4)3(5分)
(2)2A13++3 CO32-+3 H2O =2Al(OH)3↓+3CO2↑(2分)
(3)OH-+H+=H2O(2分)
(4)c(H+)<c(OH-)<c(HCO3-)<c(C1-)<c(Na+)(3分)
本题解析:(1)阴阳离子两两组合,其中必需的组合为AgNO3、Na2CO3;A、B两溶液呈碱性,A、B可能为Na2CO3、Ba(OH)2、Na OH,常温下,0.1 mol/L B溶液的pH大于13,则B为Ba(OH)2;C、D、E溶液呈酸性,且0.1 mol/L C溶液的pH等于1,则C为一元强酸HCl;A溶液与C溶液反应只有气体产生,A溶液含有CO32-,且必需为Na2CO3;A溶液与E溶液反应既有气体又有沉淀产生,E溶液含有A13+,此时阴离子只有SO42-,E为Al2(SO4)3;D为AgNO3?。
(4)将HCl溶液逐滴加入等体积、等物质量的浓度的Na2CO3溶液中,恰好完全反应生成NaHCO3和NaCl,假设NaHCO3和NaCl均为1,则含2个Na+,1个C1-,HCO3-水解,HCO3-的量要略小于1,溶液显碱性c(H+)<c(OH-),综合得:c(H+)<c(OH-)<c(HCO3-)<c(C1-)<c(Na+)。
本题难度:一般
2、选择题 下列各组离子,在水溶液中可以大量共存的是?
A.K+、H+、OH—、Cl—
B.Ba2+、Na+、NO3—、CO32—
C.Na+、H+、 Cl—、SO42—
D.Na+、Ag+、Cl—、SO42—
参考答案:C
本题解析:试题分析:A中、H+、OH—发生中和反应;B中Ba2+和CO32—反应生成沉淀;D中Ag+、Cl—生成白色沉淀,Ag+和SO42—反应生成硫酸银,微溶。故答案选C。
考点:离子共存
点评:离子共存问题是历年高考的重点,考生在备考中要注意积累常见的化学反应,并注意题文中隐藏的条件。
本题难度:困难
3、填空题 (8分)现有三种物质A、B、C,其中有一种是酸,一种是碱,一种是盐,溶于水后电离,可以产生下表中的离子:
阳离子
| Na+? H+?Ba2+
|
阴离子
| OH-? CO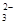 ? SO ? SO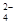 ? ?
|
为鉴别它们,分别完成以下实验,其结果如下:
① A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
② B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1) 鉴别某溶液中是否含有B中阴离子的实验操作方法是:?
(2)完成以下水溶液中的反应的离子方程式:?
A溶液与B溶液反应:?;
B溶液与沉淀E反应:?;
(3)? D与E的混合物a g,加入足量盐酸,反应完全生成标准状况时的气体b L,则E在混合物中的质量分数为?。
参考答案:(8分)(1) 取少量待测液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-
(2) CO32-+2H+=CO2↑+H2O ;? BaCO3+2H++SO42-=BaSO4↓+CO2↑+H2O?;(3)? 233b/22.4a
本题解析:由于氢离子不能和OH-以及CO32-大量共存,所以酸是硫酸。而Ba2+不能和CO32-大量共存,所以碱一定是氢氧化钡,因此盐是碳酸钠。根据实验①可知,气体是CO2,C是氢氧化钡,E是碳酸钡。碳酸钡能溶于酸中,所以B是硫酸,则A是碳酸钠。
(1)检验So42-的方法是取少量待测液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-。
(2)见答案
(3)D是硫酸钡,E是碳酸钡,由于硫酸钡和盐酸是不反应的,所以bL气体是CO2,物质的量是b/22.4mol,则碳酸钡的质量是233b/22.4,所以碳酸钡的质量分数是233b/22.4a。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合.它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法.。这类试题最关键的是寻找"突破口"!,"突破口"就是抓"特"字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
4、填空题 有A 、B 、C 、D 四种化合物, 分别由K+、Ba2+、SO42-、CO32-、SO32-、OH-中的两种组成。它们具有下列性质:
① A 不溶于水和盐酸?
② B 不溶于水但溶于盐酸并放出无刺激性气味的气体
③ C 的水溶液呈碱性,与H2SO4反应生成A
④ D 可溶于水,与H2SO4作用时放出的气体E 可使溴水褪色。
试回答以下问题推断A ~E 的化学式:
A ._______ ;B ._______ ;C ._______ ;D .________ ;E .________ 。
参考答案:A﹕BaSO4;B﹕BaCO3;C﹕Ba(OH)2;D﹕ K2SO3;E﹕SO2
本题解析:
本题难度:一般
5、选择题 向含lmolHCl和lmolMgSO4的混合溶液中加入lmol·L-1Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是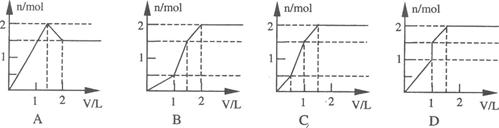
参考答案:C
本题解析:加入氢氧化钡后,立即生成硫酸钡沉淀。当溶液中的氢离子被中和后,再生成氢氧化镁沉淀。中和氯化氢需要0.5L氢氧化钡溶液,当硫酸钡恰好沉淀时,需要1L氢氧化钡溶液,而沉淀镁离子时又需要1L氢氧化钡溶液,因此当沉淀不再变化时,共计需要1.5L氢氧化钡溶液,答案选C。
本题难度:一般