1、填空题 下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝,X分解产生A、B、C三种产物的比值为1:1:1。

(1)写出下列各物质的化学式:
X:?;B:?;F:?;G:?。
(2)按要求写出下列变化的反应化学方程式:
A→D的化学反应方程式:?;
G→E的离子反应方程式:?。
参考答案:(共8分)(1)X:NH4HCO3? B:H2O? F:NO2? G:HNO3 (每空1分,共4分)
(2)2CO2+2Na2O2=2 Na2CO3+ O2?(2分,未配平不给分)
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O (2分,未配平不给分,不写气体符号扣1分)
本题解析:C能使湿润的红色石蕊试纸变蓝,这说明C应该是氨气,因此X是铵盐。A能和过氧化钠反应,说明A是水或CO2。因此D应该是氧气,所以E应该是NO,F是NO2,则G是硝酸,B是水,A是CO2。由于X分解产生A、B、C三种产物的比值为1:1:1,因此X是碳酸氢铵。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题难易适中,基础知识,侧重对学生基础知识的巩固个训练。该类试题需要注意的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
2、简答题 A、B、C、D、E、F六种的转化关系如图,其中A为应用最广泛的金属,氧化物E既能与盐酸反应,又能与NaOH溶液反应.X、Y属于同一周期,且核电荷数相关4.
上述转化中某些反应条件未指出,请回答下列问题:
(1)指出C中的化学键类型:______;D的化学式为______;元素X、Y的原子半径大小顺序是______(用元素符号表示).
(2)E与NaOH溶液反应的离子方程式为______.
(3)反应A+H2O→C+D的化学方程式为______.
(4)F能促进H2O的电离,其原因是______(用离子方程式表示).
(5)250C时,将pH=1的盐酸与pH=12的NaOH溶液按体积比1:9混合(混合时溶液体积变化忽略不计),混合均匀后所得溶液的pH=______.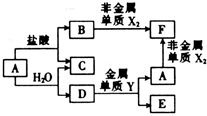
参考答案:根据题干信息氧化物E既能与盐酸反应,又能与NaOH溶液反应,可推知E为氧化铝,A为应用最广泛的金属,且能和水反应,故A应为铁,B为氯化亚铁,C为氢气,D为Fe3O4,Y为铝,
(1)非金属单质X2为氯气,F为氯化铁,氢气中的化学键是非金属元素之间所成的建,为共价键;按照元素周期表中同周期元素原子半径依次减小的递变规律,半径Al>Cl,故答案为:共价键;Fe3O4;Al>Cl;
(2)氧化铝是两性氧化物,和强碱反应得到对应的盐和水,离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)铁在高温下能和水蒸气发生置换反应,方程式为:Fe+4H2O(g)??高温?.??Fe3O4+4H2,故答案为:Fe+4H2O(g)?高温?.??Fe3O4+4H2;
(4)氯化铁中的Fe3+能水解,能水解的盐对水的电离均起到促进作用,水解方程式为:3Fe3++3H2O?

?Fe(OH)3+3H+,故答案为:3Fe3++3H2O?

?Fe(OH)3+3H+;
(5)设强酸和强碱的体积分别为1L和9L,强酸和强碱混合后溶液中[H+]=盐酸中氢离子的物质的量-氢氧化钠中氢氧根的物质的量溶液的总体积=0.1mol/l×1L-0.01mol/l×9L10L=0.001mol/l,PH=3,故答案为:3.
本题解析:
本题难度:一般
3、选择题 X、Y、Z、W四种物质之间有转化关系如题8图所示(反应条件略),下列有关X、Y的说法错误的是
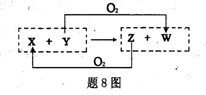
A.X为H2O,Y为F2
B.x为SiO2,Y为c
C.x为CO2,Y为Mg?
D.x为H2O,Y为? C.
参考答案:A
本题解析:A中氟气和水反应生成HF和OF2,HF和氧气不能反应,所以选项A不正确,其余都是正确的,答案选A。
本题难度:简单
4、填空题 A、B、C、D、E、F、G为常见物质,其中C为淡黄色固体.甲、乙、丙为常见气体.各物质的转化关系如图所示.
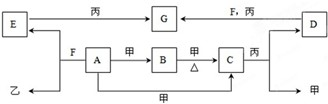
回答下列问题:
(1)C的名称是______;D的俗称______;F的化学式______;
A+甲→C的反应条件是______.
(2)在一定条件下,甲+乙→F,该反应属于______.
①氧化还原反应②非氧化还原反应③化合反应④分解反应 ⑤复分解反应⑥置换反应⑦离子反应
(3)写出下列变化的离子方程式.
①A+F→E+乙:______.
②D+F+丙→G:______.
参考答案:A、B、C、D、E、F、G为常见物质,其中C为淡黄色固体,且C是化合物,甲是气体,所以C是过氧化钠,甲是氧气,A和氧气反应生成B,B和氧气反应生成过氧化钠,则A是钠,B是氧化钠,钠和F反应生成气体乙,且乙是常见气体,则乙是氢气,E能和气体丙反应生成G,C和丙反应生成氧气和D,丙是气体,D能和丙、F反应生成G,则丙是二氧化碳,D是碳酸钠,F是水,E是氢氧化钠,G是碳酸氢钠.
(1)通过以上分析知,C是过氧化钠,其名称是过氧化钠,D是碳酸钠,其俗称是纯碱或苏打,F是水,其化学式为:H2O,钠在氧气中燃烧生成过氧化钠,所以其条件是点燃,
故答案为:过氧化钠;纯碱或苏打;H2O;点燃;
(2)在一定条件下,氢气和氧气反应生成水,该反应中有元素化合价变化,所以是氧化还原反应,且该反应是化合反应,故选①③
(3)①钠和水反应生成氢氧化钠和氢气,离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,
故答案为2Na+2H2O═2Na++2OH-+H2↑;
②碳酸钠和水、二氧化碳反应生成碳酸氢钠,离子反应方程式为:CO32-+H2O+CO2═2HCO3-,
故答案为:CO32-+H2O+CO2═2HCO3-.
本题解析:
本题难度:一般
5、填空题 (12分)a、b、c、d为原子序数依次增大的短周期元素,b、c、d同周期,由a、b、c、d四种元素形成的常见酸式盐A有如图所示的转化关系(图中每种字母表示一种单质或化合物)。
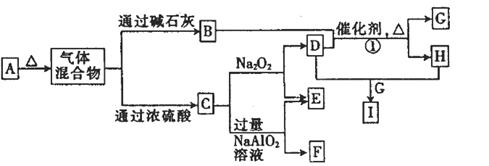
(1)物质C的结构式为________________。
(2)写出下列物质的化学式:F________,I________。
(3)写出反应①的化学方程式: ______________________。
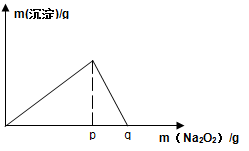
(4)将F与一定量盐酸混合,二者恰好反应得到溶液M,在M中加入Na2O2时,加入Na2O2的质量与产生沉淀的质量具有如图所示关系,则p点时产生沉淀与放出气体的物质的量之比为?,从开始加Na2O2固体至q点的整个过程中,总反应的离子方程式为?。
(4)将A和E组成的固体混合物X g 溶于水配成溶液,向其中慢慢滴入I的稀溶液,测得加入I溶液的体积与生成C的体积(标准状况)如下表所示。则I溶液的物质的量浓度为_____。
?I 溶液的体积(mL)
| 4
| 8
| 15
| 20
| 50
| 120
| 150
| ?
|
C的体积(mL)
| 0
| 0
| 112
| 224
|  896 896
| 2240
| 2240
参考答案:(12分)
(1)O=C=O(2分)?(2)Al(OH)3? HNO3?(各1分)
(3)4NH3+5O2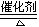 4NO+6H2O?(2分) 4NO+6H2O?(2分)
(4)4:3 (2分)? Al3++2 Na2O2= 4Na++ Al O2-+ O2↑(2分)(5)1mol/L(2分)
本题解析:略
本题难度:一般
|