1、选择题 在一些高档茶叶、点心等食品的包装盒中有一个小袋,将小袋打开,可以看到灰黑色粉末,其中有些已变成棕褐色。将灰黑色粉末溶于稀盐酸,取上层清液,滴入几滴氯水,再滴加KSCN溶液,马上出现血红色。以下结论不正确的是
A.该灰黑色粉末用作抗氧化剂
B.该灰黑色粉末不可食用
C.小袋中原来装有铁粉
D.小袋中原来装有氧化铁
参考答案:D
本题解析:黑色粉末部分变为红棕色溶于盐酸后取上层清夜,滴加氯水后再加入KSCN溶液,马上出现血红色说明原粉末中含有黑色的铁粉和红棕色的氧化铁,铁粉可以用作抗氧化剂,不可以食用,所以答案选D。
本题难度:简单
2、选择题 将充有amLNO和bmLNO2的试管倒立于水槽中,然后再通入amLO2,若a<b,则充分反应后,试管内剩余气体的体积是
A.(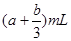
B.
C.
D.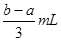
参考答案:D
本题解析:气体混合后首先发生反应NO+NO2+O2+H2O=2HNO3,a<b,则NO2过量,剩余(b-a)ml。过量的NO2继续和水反应3NO2+H2O=2HNO3+NO,所以最终剩余的气体是NO,物质的量是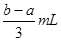 ,答案选D。
,答案选D。
点评:该题是中等难度的试题,试题综合性强,难易适中。该题的关键是明确反应的原理,并能依据题意灵活运用、分析、判断即可,有助于培养学生的逻辑推理能力和发散思维能力。
本题难度:简单
3、选择题 近年来,加“碘”食盐较少使用碘化钾,因其口感苦涩且在贮藏和运输中易变化,目前代之加入的是……( )
A.I2
B.KIO3
C.NaIO
D.KIO
参考答案:B
本题解析:I2易升华,NaIO和KIO都不稳定。
本题难度:简单
4、实验题 (15分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。

回答下列问题:
(1)A中加入的物质是______________,发生反应的化学方程式是_____________。
(2)B中加入的物质是________,其作用是?。
(3)实验时在C中观察到的现象是__________________________,发生反应的化学方程式是____________________。
(4)实验时在D中观察到的现象是________,D中收集到的物质是________,检验该物质的方法和现象是________________________。
参考答案:(1)固体氯化铵和氢氧化钙、2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)碱石灰(或氧化钙)?除去氨气中的水蒸气
(3)黑色粉末逐渐变为红色?3CuO+2NH3 3Cu+N2+3H2O
3Cu+N2+3H2O
(4)出现无色液体?氨水
用红色石蕊试纸检验,试纸变蓝,说明有氨气存在,用无水硫酸铜粉末检验,无水硫酸铜变蓝,说明有水存在。
本题解析::C为氨气还原氧化铜的装置,A为制氨气的发生装置,B为干燥装置,水蒸气在D中冷凝,NH3溶于水形成氨水,E中收集N2。
(1)实验室加热氯化铵和氢氧化钙混合物制氨气,方程式为:
NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(2)B中固体为碱石灰或生石灰或固体氢氧化钠,作用是除去氨气中的水蒸气。
(3)C中现象为黑色固体变红,反应方程式为3CuO+2NH3 3Cu+N2+3H2O。
3Cu+N2+3H2O。
(4)水蒸气在D中冷凝,NH3溶于水形成氨水。可用红色石蕊试纸检验其中的NH3、用无水硫酸铜检验其中的H2O。
点评:本题综合考查NH3的制备和性质。
本题难度:一般
5、选择题 将充满20mLNO的试管倒置于盛有蒸镏水的烧杯中,然后向试管里通入纯氧气,当试管内液面稳定在试管容积的4/5时,则通入O2为可能?(?)
A.9mL
B.15 mL
C.19mL
D.31mL
参考答案:C
本题解析:NO和O2在水中反应的方程式为4NO+3O2+2H2O=4HNO3。若NO过量,则参加反应的NO是16ml,消耗氧气是12ml。若氧气过量,20mLNO消耗的氧气是15ml,剩余氧气是20ml×1/5=4ml,所以通入的氧气是19ml,答案选C。
本题难度:一般