| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《化学平衡》考点预测(2019年强化版)(四)
参考答案:A 本题解析:略 本题难度:一般 3、选择题 可逆反应,C(s)+H2O |
参考答案:B
本题解析:略
本题难度:简单
4、选择题 把HI气体充入密闭容器中在一定条件下发生反应.2HI(g)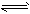 H2(g)+I2(g),在反应趋向化学反应限度的过程中,下列说法正确的是
H2(g)+I2(g),在反应趋向化学反应限度的过程中,下列说法正确的是
[? ]
参考答案:B
本题解析:
本题难度:一般
5、简答题 (1)t℃时,将2molSO2和1mol?O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2?(g)+O2?(g)?2SO3?(g);△H=-196kJ?mol-1.2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ.请填写下列空白:①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)______
A.容器内压强不再发生变化?
B.SO2的体积分数不再发生变化?
C.容器内气体质量不再发生变化?
D.容器内气体密度不再发生变化?
②从反应开始至达到化学平衡,生成SO3平均反应速率为______;该条件下反应的平衡常数K=______(精确到小数点后两位)?
③反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是______
A.向容器中通入少量O2
B.向容器中通入少量SO2?
C.使用催化剂
D.降低温度?
E.向容器中通入少量氦气?
④上述反应达平衡后,判断下列情况下平衡移动的方向(填“向右”、“向左”或“不移动).?
再通入1.6molSO2、0.8molO2、0.4molSO3,______;再通入0.2molSO2、0.2molSO3,______.
(2)工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等.已知25℃时,Ksp(CaSO4)=7.10×10-5.向0.100L?含CaSO4固体的溶液中加入2.22gCaCl2粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将______(填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将______.
参考答案:(1)①化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变.
A.对于反应前后体积变化的反应,容器内压强不再发生变化,说明反应达到平衡状态,故A正确;
B.SO2的体积分数不再发生变化,说明反应达到平衡状态,故B正确;
C.反应前后气体质量守恒,容器内气体质量不再发生变化,不能说明达到平衡状态,故C错误;
D.反应前后气体质量守恒,容器内气体质量不发生变化,容器体积保持不变,所以容器内气体密度不会发生变化,故D错误.
故选AB;
②根据热化学方程式知道,当放出热量为39.2kJ时,生成三氧化硫的量为2×39.2196=0.4mol,则消耗二氧化硫和氧气的量分别是0.4mol和0.2mol,所以生成SO3平均反应速率为v=△c△t=0.4mol2L2min=0.1mol/(L/min),达到化学平衡时二氧化硫、氧气、三氧化硫的量分别是:2mol-0.4mol2L=0.8mol/L,1mol-0.2mol2L=0.4mol/L,0.4mol2L=0.2mol/L,所以K=[SO3]2[SO2]2[O2]=0.220.82?0.4≈0.16L/mol,故答案为:0.1mol/(L?min);0.16L/mol;
③A.向容器中通入少量O2,即增大氧气的浓度,能使平衡正向移动并能提高SO2转化率,故A正确;
B.向容器中通入少量SO2,即增大二氧化硫的浓度,能使平衡正向移动但是能降低了SO2转化率,故B错误;
C.使用催化剂,不会影响化学平衡的移动,也不会改变二氧化硫的转化率,故C错误;
D.降低温度,化学平衡正向移动,并能提高SO2转化率,故D正确;
E.向容器中通入少量氦气,当恒容时,各组分的浓度不变,则平衡不移动,故E错误;
故选AD;
(4)再通入1.6molSO2、0.8molO2、0.4molSO3,和原来平衡的量一样再投料,则相当于压缩体系为原体积的一半,所以体系的压强增大,平衡正向移动,故答案为:向右;
②再通入0.2molSO2、0.2molSO3,则Qc=C(SO3)2C(SO2)2?C(O2)=(0.62)2(1.82)2×0.82≈1.39L/mol>K,所以平衡向左移动,故答案为:向左;
(2)根据沉淀溶解平衡:CaSO4(s)?Ca2+(aq)+SO42-(aq),当增大钙离子的浓度时,平衡向逆反应方向移动,所以硫酸钙的固体质量减小,但是Ksp(CaSO4)只受温度的影响,所以此时Ksp(CaSO4)不变,故答案为:增大;不变.
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《原电池原理.. | |