|
1、选择题 为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
?
| 被提纯的物质
| 除杂试剂
| 分离方法
| A
| 乙酸乙酯(乙酸)
| CCl4
| 萃取、分液
| B
| 乙烷(乙烯)
| 高锰酸钾溶液
| 洗气
| C
| 乙醇(乙酸)
| 新制氧化钙
| 蒸馏
| D
| 苯(溴)
| 碘化钾溶液
| 分液
2、填空题 (4分)某无色溶液可能是由Na2CO3、 NaOH 、MgCl2、AlCl3、BaCl2 、Fe2(SO4)3 、(NH4)2SO4溶液中的两种或两种以上混合而成。取该溶液少许于试管,向其中加入H2SO4,有白色沉淀生成,继续加入H2SO4时沉淀又完全消失,整个实验过程中无气体产生,则原溶液是由??和??混合而成。实验过程中有关的离子反应方程式是?
3、填空题 多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有钙、铁、镁等离子)制备BaCl2·2H2O,工艺流程如图所示。已知常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4。
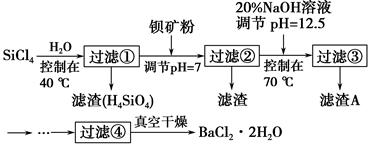
(1)SiCl4水解控制在40 ℃的原因是___________________________________。
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)?ΔH1=+47 kJ·mol-1
Si(s)+3HCl(g)=SiHCl3(s)+H2(g)?ΔH2=-189 kJ·mol-1
则由SiCl4制备硅的热化学方程式为__________________________________。
(2)加钡矿粉时生成BaCl2的离子反应方程式是_________________________。
(3)加20% NaOH溶液调节pH=12.5,得到滤渣A的主要成分是________,控制温度70 ℃的目的是____________________________________________。
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到BaCl2·2H2O。实验室中蒸发浓缩,用到的含硅酸盐的仪器有__________种。
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是____________。
4、选择题 (辽宁省大连市八中2007—2008学年度高三上学期期中考试,化学,9)下列每组各有三对物质,它们都能用分液漏斗分离的是
①乙酸乙酯和水,酒精和水,苯酚和水
②二溴乙烷和水,溴苯和水,硝基苯和水
③甘油和水,乙醛和水,乙酸和乙醇
④油酸和水,甲苯和水,乙烷和水
A.①②
B.②④
C.③④
D.①②④
5、选择题 有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可以将它们鉴别出来,这种试剂是
A.NaOH
B.H2SO4
C.BaCl2
D.KSCN
|
|