1、填空题 工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)  2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
时间(h)
物质的量(mol)
| 0
| 1
| 2
| 3
| 4
|
N2
| 1.50
| n1
| 1.20
| n3
| 1.00
|
H2
| 4.50
| 4.20
| 3.60
| n4
| 3.00
|
NH3
| 0
| 0.20
| ?
| 1.00
| 1.00
|
?
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
参考答案:(1)②④ (2)①27.78 ②0.05 ③0.15
④正反应
本题解析:(1)①所述反应达到平衡状态;②生成2 mol NH3的同时生成2 mol H2,正反应速率大于逆反应速率,反应向正反应方向进行;③未指明化学反应速率的方向,无法判断;④混合气体的平均摩尔质量增大,说明气体的物质的量减小,反应向正反应方向进行;⑤因为容积固定,所以密度始终不变。
(2)①2 h时消耗N2的物质的量为1.50 mol-1.20 mol=0.30 mol,由热化学方程式,可知该反应放出的热量为92.60 kJ·mol-1×0.30 mol=27.78 kJ。
②v(N2)=v(NH3)/2=0.20 mol÷(2 L×1 h)÷2=0.05 mol·L-1·h-1。
③由表中数据可知,第3、4 h时反应已达到平衡状态,故N2、H2、NH3的平衡浓度为0.50 mol·L-1、1.50 mol·L-1、0.50 mol·L-1。故平衡常数K=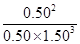 ≈0.15。
≈0.15。
④反应物和生成物各加入1.00 mol后,N2、H2、NH3的浓度为1.00 mol·L-1、2.00 mol·
L-1、1.00 mol·L-1,此时的Qc=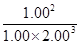 =0.125<K,故平衡向正反应方向移动。
=0.125<K,故平衡向正反应方向移动。
本题难度:一般
2、选择题 反应N2(g)+3H2(g)?2NH3(g),如果2min内N2的浓度由6mol/L减小到2mol/L,那么用N2浓度变化来表示的该反应在这2min内的反应速率为( )
A.2mol/(L?min)
B.3mol/(L?min)
C.4mol/(L?min)
D.6mol/(L?min)
参考答案:2min内N2的浓度由6mol/L减小到2mol/L,
则氮气的浓度变化量为6mol/L-2mol/L=4mol/L,
故用氮气表示的反应速率为4mol/L2min=2mol/(L?min),
故选:A.
本题解析:
本题难度:简单
3、选择题 据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实
2CO2(g) + 6H2(g) CH3CH2OH(g) + 3H2O(g)下列叙述错误的是
CH3CH2OH(g) + 3H2O(g)下列叙述错误的是
A.使用催化剂可大大提高生产效率
B.反应需在300 ℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
参考答案:B
本题解析:A、催化剂能降低反应活化能,加快化学反应速率,则在一定时间内提高了生产效率,正确;B、反应需在300℃进行可能是为了获得较快的反应速率,不能说明反应是吸热还是放热,错误;C、充入大量CO2气体,能使平衡正向移动,提高H2的转化率,正确;D、从平衡混合物中及时分离出产物,使平衡正向移动,可提高CO2和H2的转化率,正确。
本题难度:一般
4、填空题 汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.某同学为控制污染,对该反应进行研究.
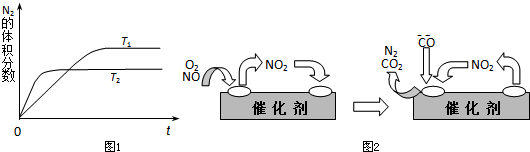
(1)如图1表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,根据图象判断反应N2(g)+O2(g)?2NO(g)为______(填“吸热”或“放热”)反应.
(2)2000℃时,向容积为2L的密闭容器中充入10molN2与5mol?O2,达到平衡后NO的物质的量为2mol,则2000℃时该反应的平衡常数K=______.该温度下,若开始时向上述容器中充入N2与O2均为1mol,则达到平衡后N2的转化率为______.
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置.净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图2所示.写出上述变化中的总化学反应方程式:______.
参考答案:(1)根据图象判断,T2曲线先到达平衡,反应速率大,温度较高,而温度升高,氮气的体积分数减小,说明升高温度平衡向正反应移动,升高温度向吸热方向进行,故正反应为吸热反应.
故答案为:吸热
(2)利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量.
? N2(g)+O2(g)?2NO(g),
起始(mol):10?5?0
反应(mol):1? 1? ? 2
平衡(mol):9? 4?2
所以平衡常数k=[c(NO)]2c(N2)?c(O2)=(2mol2L)29mol2L×4mol2L=19;
令N2转化的物质的量为xmol,则
? ?N2(g)+O2(g)?2NO(g),
起始(mol):1? 1?0
反应(mol):x?x? 2x
平衡(mol):1-x?1-x?2x
所以(2xmol2L)2(1-x)mol2L×(1-x)mol2L=19,解得x=17,
N2的转化率为17mol1mol×100%=14.3%.
故答案为:19;14.3%
(3)NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2,反应方程式为2NO+O2+4CO=4CO2+N2.
故答案为:2NO+O2+4CO=4CO2+N2
本题解析:
本题难度:一般
5、选择题 已知2SO2(g)+O2(g)  ?2SO3(g)(正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是
?2SO3(g)(正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是
A.若降低温度,可以加快反应速率
B.使用催化剂是为了加快反应速率
C.在上述条件下,SO2能完全转化为SO3
D.达到平衡时,SO2和SO3的浓度一定相等
参考答案:B
本题解析:降低温度会降低反应速率,A不正确。反应属于可逆反应,所以不可能完全转化生成SO3,C不正确。平衡时物质的浓度不再发生变化,但物质之间的浓度不一定相等,D不正确。所以正确的答案是C。
本题难度:一般