1、选择题 反应2SO2+O2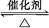 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
A.0.1 s
B.2.5 s
C.10 s
D.5 s
2、选择题 下列关于O2+2SO2 2 SO3的叙述错误的是
2 SO3的叙述错误的是
A.增加O2的浓度能加快反应速率
B.若O2足量,则SO2可以完全转化为SO3
C.加入催化剂能加快反应速率
D.升高体系温度能加快反应速率
3、选择题 下列措施能减慢化学反应速率的是
A.将煤块粉碎后燃烧
B.用2mol/L的盐酸代替0.1mol/L的盐酸反应制氢气
C.用过氧化氢溶液制氧气时添加少量二氧化锰粉末
D.将食物贮藏在冰箱中
4、填空题 (16分)I.一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
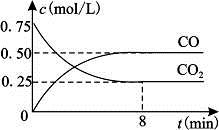
(1)8分钟内,CO的平均反应速率v(CO)=___________(结果保留3位有效数字)。
(2)1100℃时该反应的平衡常数K= (填数值);该温度下,若在8分钟时CO2和CO各增加0.5mol/L,此时平衡 移动(填“正向”、“逆向”或“不”)。
(3)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器
| 甲
| 乙
|
反应物投入量
| 3molFe、2molCO2
| 4molFeO、3molCO
|
CO的浓度(mol/L)
| C1
| C2
|
CO2的体积分数
| φ1
| φ2
|
体系压强(Pa)
| P1
| P2
|
下列说法正确的是___________(填序号);
A.2C1 = 3C2 B.φ1 = φ2 C.P1<P2
II.(4)已知:①Fe(OH)3(aq) Fe3+(aq)+3OH-(aq);ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq);ΔH=" a" kJ?mol-1
②H2O(l) H+(aq)+OH-(aq);ΔH="b" kJ?mol-1
H+(aq)+OH-(aq);ΔH="b" kJ?mol-1
请写出Fe3+发生水解反应的热化学方程式: 。
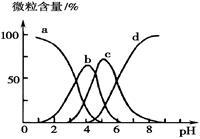
(5)柠檬酸(用H3R表示)可用作酸洗剂,除去水垢中的氧化铁。
溶液中H3R、H2R-、HR2--、R3-的微粒数百分含量与pH的关系如图所示。图中a曲线所代表的微粒数的百分含量随溶液pH的改变而变化的原因是 (结合必要的方程式解释)。调节柠檬酸溶液的pH=4时,溶液中上述4种微粒含量最多的是 (填微粒符号)。
III.(6)高铁酸钠(Na2FeO4)广泛应用于净水、电池工业等领域,工业常用电解法制备,其原理为
Fe+2OH--+2H2O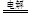 FeO42--+3H2↑
FeO42--+3H2↑
请设计一个电解池并在答题卡的方框内画出该装置的示意图并作相应标注。

其阳极反应式为:________________________________。
5、填空题 (13分)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1moleO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________
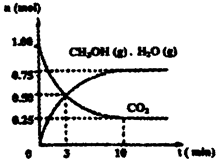
②下列措施中一定不能使CO2的转化率增大的是______________。
A.在原容器中再充入lmolCO2
B.在原容器中再充入1molH2
C.在原容器中充入lmol氦气
D.使用更有效的催化剂

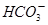 +H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
+H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。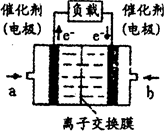 ?
?