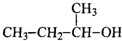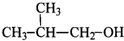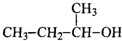|
|
|
高考化学必考知识点《盐类水解的原理》练习题(五)
2019-07-04 00:52:18
【 大 中 小】
|
1、填空题 (1)AgNO3的水溶液呈酸性的原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有 ,其浓度由大到小的顺序为 ,氨水的浓度a 0.01 mol·L-1(填“>”、“<”或“=”)。
(3)用已知浓度的NaOH标准溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.未用标准液润洗碱式滴定管;
B.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
|
2、选择题 对于0.1?mol·L-1?Na2SO3溶液,正确的是
A.升高温度,溶液pH降低
B.c(Na+) = 2c(SO32-) + c(HSO3-) + c(H2SO3)
C.c(Na+) + c(H+) =2c(SO32-) + 2c(HSO3-) + c(OH-)
D.加入少量NaOH固体,c(SO32-)与c(Na+)均增加
3、选择题 25℃时,弱酸的电离平衡常数如表所示,下列说法正确的是

A.物质的量浓度相等的三种溶液中,pH大小关系为:pH(NaCN)> pH(Na2 CO3)pH(CH3 COONa)
B.amol·L-1 HCN与b mol·L-1 NaOH溶液等体积混合所得的溶液中c(Na+)>c(CN-),则a一定小于b
C.向冰醋酸中逐滴加水稀释的过程中,溶液导电能力先增大,后减小
D.将0.1 mol·L-1的Na2 CO3溶液逐滴加入到等浓度的HCN溶液中,无明显现象,说明未反应
|
4、选择题 为了配制CH3COO-与Na+离子物质的量浓度值比为1:1的溶液,可向醋酸钠溶液中加入
A.适量的盐酸
B.适量的NaOH固体
C.适量的KOH 固体
D.适量的NaCl固体
5、选择题 下列物质中,既能发生消去反应生成烯烃,又能发生氧化反应生成醛的是( )
A.CH3OH
B.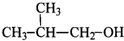
C.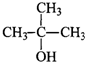
D.