1、简答题 已知a、e、I为三种由短周期元素构成的10个电子的粒子,其结构特点如下:
| 粒子代码 | a | e | I
原子核数
单核
两核
四核
粒子的电荷数
一个单位正电荷
一个单位负电荷
0
|
物质A由a、e?构成,B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①-⑤都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去.请填写下列空白:
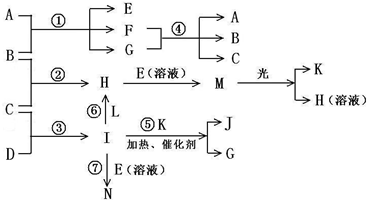
(1)写出下列物质的化学式:B______,J______.
(2)写出下列反应的离子反应方程式:H+E(溶液)→M______,F+G→A+B+C______;
(3)E(溶液)能与I以1:2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式______;
(4)L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素CO(NH2)2和物来源:91考试网 91ExaM.org质H,写出L
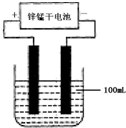
的电子式______;
(5)常温下,实验室模拟工业反应④的过程如图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=______.(假设气体完全逸出,溶液体积不变)
参考答案:根据原子核数和带电荷数可知a为Na+,e为OH-,I为NH3,物质A由a、e?构成,应为NaOH,B、C、D、K都是单质,反应①-⑤都是用于工业生产的反应,能与NaOH反应的工业生成为工业制备漂白液的反应,为Cl2和NaOH的反应,则B为Cl2,C为H2,D为N2,H为HCl,反应④应为工业电解饱和食盐水,则E为NaClO,M为HClO,见光分解生成氧气,则K为O2,和O2反应生成NO和H2O,则G为H2O,J为NO,F为NaCl,E(溶液)能与I以1:2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,反应的方程式为NaOCl+2NH3=N+NaCl+H2O,根据质量守恒可知N为N2H4,各原子均已达到惰性气体的稳定结构,电子式应为
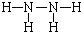
,L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素
CO(NH2)2和物质H,因H为HCl,则L含有C、O、Cl三种元素,结合质量守恒可知L应为COCl2,反应的方程式
为COCl2+2NH3=CO(NH2)2+2HCl,
(1)由以上分析可知B为Cl2,J为NO,故答案为:Cl2;NO;?
(2)H+E(溶液)→M的离子方程式为H++ClO-═HClO,F+G→A+B+C为工业电解饱和食盐水的反应,反应的离子方程式为
2Cl-+2H2O?电解?.?Cl2+H2+2OH-,
故答案为:H++ClO-═HClO;?2Cl-+2H2O?电解?.?Cl2+H2+2OH-;
(3)由以上分析可知N的电子式为
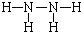
,故答案为:
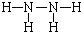
;?
(4)L为COCl2,电子式为
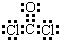
,故答案为:
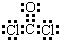
;?
(5)B为Cl2,反应的方程式为2Cl-+2H2O?电解?.?Cl2+H2+2OH-,n(Cl2)=0.112L22.4L/mol=0.005mol,则生成n(OH-)=0.01mol,
c(OH-)=0.01mol0.1L=0.1mol/L,则pH=13,
故答案为:13.
本题解析:
本题难度:一般
2、填空题 在一次兴趣小组活动中,一小组利用物质间的互变,设计成一平面“魔方”如图所示。已知:
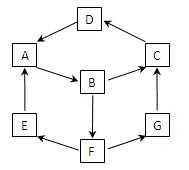
①A、B、C、D、G含有同种元素。
②E是通常情况下密度最小的气体;B与硝酸银溶液反
应生成不溶于稀硝酸的白色沉淀;B也能将一种能形成酸
雨的氧化物氧化为F,F是一种含氧酸,且F的稀溶液
能与A反应生成E和G。
物质
| 纯A(单质)
| B(溶液)
| D(固体)
| G(溶液)
|
颜色
| 银白色
| 黄色
| 红棕色
| 浅绿色
|
③几种物质的部分物理性质:
依据以上信息填空:
(1)G生成C的过程中所出现的现象为?;
(2)写出下列反应的化学方程式:
A→B :?;
(3)写出下列反应的离子方程式:
B→F:?;
酸性条件下,G与次氯酸溶液反应:?;
(4)使一定质量的Zn与100mL18.5 mol·L-1酸F的浓溶液充分反应,Zn完全溶解,同时生成标准状况下的气体A 33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol·L-1,则气体A的成份及体积比为?。
参考答案:(1)先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色。
(2)
(3)2Fe3++SO2+2H2O = 2Fe2++SO42-+4H+? 2Fe2++HClO + H+ = 2Fe3++Cl-+H2O
(4)V(SO2):V(H2)=" 1:4?"
本题解析:略
本题难度:一般
3、推断题 A、B、C、D均为氢化物,其分子中所含原子数依次为2、3、4、4。A、C的分子中原子个数比均为1:1,且电子总数均为18;B与C的元素种类相同;B、D的分子均含10个电子,B与D反应得到一种一元弱碱。请回答:
(1)A分子的电子式是____________。
(2)实验室制备D的化学方程式是____________________;检验D是否收集满的方法是____________。
(3)实验室利用稀硫酸与过氧化钡发生复分解反应来制备C,该反应的化学方程式是_______________。
(4)工业上利用电解KHSO4溶液所得的产物与水反应制备C。电解KHSO4溶液时,阳极反应式是2HSO4--2e-=S2O82-+2H+,阴极反应式是____________;已知1 molS2O82-与水反应得到C时转移了2 mol e-,则该反应的离子方程式是________________。
参考答案:(1) (2)2NH4Cl+Ca(OH)2
(2)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O;用湿润的红色石蕊试纸接近容器口,观察到试纸变蓝,证明已收集满
CaCl2+2NH3↑+2H2O;用湿润的红色石蕊试纸接近容器口,观察到试纸变蓝,证明已收集满
(3)BaO2+H2SO4=H2O2+BaSO4↓
(4)2H++2e-=H2↑;S2O82-+2H2O=H2O2+2HSO4-
本题解析:
本题难度:一般
4、填空题 已知A为常见的金属单质,根据图所示的关系:
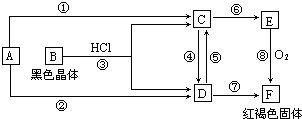
(1)确定A、B的化学式,A为______,B为______.
(2)C和D可相互转化,描述C→D溶液的颜色变化:______.
④的离子方程式:______.
⑤的离子方程式:______.
(3)由E→F的实验现象为:______.
参考答案:根据物质间的相互反应及反应现象推断,F是红褐色固体,则F是氢氧化铁,则D含有铁离子,E和氧气反应生成氢氧化铁,E是氢氧化亚铁,C含有亚铁离子,A是常见金属单质,根据元素守恒知,A是铁,B和盐酸反应生成亚铁离子和铁离子,且B是黑色晶体,所以B是四氧化三铁,四氧化三铁和盐酸反应生成氯化亚铁和氯化铁,所以C是氯化亚铁,D是氯化铁.
(1)通过以上分析知,A是Fe,B是Fe3O4,故答案为:Fe;Fe3O4;
(2)氯化亚铁是浅绿色溶液,氯化铁是黄色溶液,所以C→D溶液的颜色变化是由浅绿色到黄色;
④氯化亚铁和氯气反应生成氯化铁,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
⑤铁和铁离子反应生成亚铁离子,离子方程式为:Fe+2Fe3+=3Fe2+;
故答案为:溶液由浅绿色到黄色;2Fe2++Cl2=2Fe3++2Cl-;Fe+2Fe3+=3Fe2+;
(3)氢氧化亚铁和氧气、水反应生成红褐色氢氧化铁,反应现象为:沉淀由白色很快变为灰绿色,最后变为红褐色,
故答案为:沉淀由白色很快变为灰绿色,最后变为红褐色.
本题解析:
本题难度:简单
5、选择题 如图B为常见金属或非金属单质,有下列转化关系:
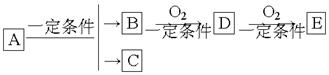
若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是
A.NaCl?B.AlCl3? C.H2O2?D.KCl
参考答案:A
本题解析:略
本题难度:简单