1、选择题 把vmL物质的量浓度为amol/L的FeCl3溶液加水稀释到2vmL后,该溶液中Cl-的物质的量是
A.
B.3av
C.
D.
参考答案:C
本题解析:分析:溶液稀释前后氯离子的浓度变化,氯离子的物质的量不变,等于vmL物质的量浓度为amol/L的FeCl3溶液中含有的氯离子的物质的量,根据氯化铁的化学式计算浓度为amol/L的FeCl3溶液中氯离子的浓度,再根据n=cV计算.
解答:浓度为amol/L的FeCl3溶液中氯离子的浓度为3amol/L,
所以vmL溶液中含有的氯离子的物质的量为V×10-3L×3amol/L=3aV×10-3mol.
故选C.
点评:本题考查物质的量浓度的计算,难度较小,注意溶液稀释前后溶质的物质的量不变.
本题难度:困难
2、选择题 下列物质中,与0.1molH2O含相同氢原子数的物质是
A.0.3molHNO3
B.0.1NA个H3PO4分子
C.2.4gCH4
D.标准状况下4.48LHCl
参考答案:D
本题解析:分析:根据N=nNA可知,H原子的物质的量相同,则H原子数目相同,结合各物质的量化学式计算含有的H原子数目,
解答:0.1molH2O含氢原子的物质的量0.2mol.
A、0.3molHNO3含氢原子的物质的量0.3mol,故A错误;
B、0.1NA个H3PO4分子中含有氢原子的物质的量0.3mol,故B错误;
C、2.4gCH4含氢原子的物质的量 ×4=0.6mol,故C错误;
×4=0.6mol,故C错误;
D、标准状况下4.48LHCl含有氢原子的物质的量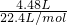 ×1=0.2mol,故D正确.
×1=0.2mol,故D正确.
故选:D.
点评:考查物质的量的有关计算,难度较小,注意公式的利用,加强基础知识的掌握.
本题难度:简单
3、选择题 向NaBr、NaI、Na2S03混合液中,通入过量氯气后,将溶液蒸干并充分灼烧,得到剩余固体物质的组成是
A.NaCl?NaBr?NaS04
B.NaCl?Na2S04
C.NaCl?Na2S03
D.NaCl?NaI?Na2S04
参考答案:B
本题解析:分析:在Br-、I-、SO32-中,还原性由弱到强为Br-<I-<SO32-,向含有NaBr和NaI、Na2S03的混合溶液中通入过量氯气发生:Cl2+Na2SO3+H2O=Na2SO4+2HCl、2NaI+Cl2=2NaCl+I2、2NaBr+Cl2=2NaCl+Br2,结合Br2和I2的性质分析.
解答:向含有NaBr和NaI、Na2S03的混合溶液中通入过量氯气发生:Cl2+Na2SO3+H2O=Na2SO4+2HCl、2NaI+Cl2=2NaCl+I2、2NaBr+Cl2=2NaCl+Br2,
加热时,Br2、HCl易挥发,I2易升华,最后所得固体只有NaCl和Na2SO4,
故选B.
点评:本题考查卤素知识,明确离子反应先后顺序及生成物的性质是解本题关键,难度不大.
本题难度:困难
4、选择题 下列说法正确的是
A.在标准状况下,1mol水的体积是22.4L
B.1molH2所占的体积约为22.4L
C.在标准状况下,NA个分子所占的体积约为22.4L
D.在标准状况下,1molNH3和CO混合气体所占的体积约为22.4L
参考答案:D
本题解析:分析:A根据气体摩尔体积的使用范围判断;
B根据气体摩尔体积的使用条件判断;
C、根据气体摩尔体积的使用范围判断;
D根据气体摩尔体积的定义判断.
解答:A、气体摩尔体积的使用范围是气体,水是液体,故A错误.
B、在标况下,1molH2所占的体积约为22.4L,没有前提条件,故B错误.
C、未注明该物质的状态,不能确定其体积,故C错误.
D、在标准状况下,1mol任何气体所占的体积约为22.4L,任何气体既值纯净物又指混合物,故D正确.
故选:D
点评:本题考查的是气体摩尔体积,注意气体摩尔体积的使用范围、条件,正确理解定义中“任何”的含义.
本题难度:一般
5、选择题 下列物质在光照时不反应的是 ?
A.氢气和氯气的混合气体
B.次氯酸
C.氢气和氧气的混合气体
D.氯水
参考答案:C
本题解析:试题分析:氢气和氯气的混合气体在光照的条件下,能迅速化合生成氯化氢;次氯酸见光易分解生成氯化氢和氧气;氢气和氧气在光照的条件下不能化合,二者只有在点燃的条件下,才能化合生成水;氯水中含有次氯酸,光照时次氯酸易分解,答案选C。
考点:考查化学反应中条件的选择
点评:本题属于基础性试题,难度不大。解题的关键是学生要熟练记住常见化学反应的条件以及常见物质的化学性质。
本题难度:困难