1、填空题 I.常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示。回答下列问题
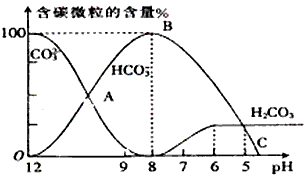
(1)H2CO3、HCO3-、CO32-中不能大量共存于同一溶液中的是___________________。
(2)实验室可用“双指示剂法”测定碳酸钠、碳酸氢钠混合溶液中各种物质的含量,操作步骤如下:
①取固体样品配成溶液;
②取25mL样品溶液加指示剂A,用0.1010mol/LNaOH标准溶液滴定至终点;
③再加指示剂B,再用0.1010mol/LNaOH标准溶液滴定至终点……
指示剂B的变色范围在pH=______左右最理想。
(3)当pH=7时,此时再滴入盐酸溶液所发生反应离子方程式是____________________。
(4)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=
2︰1时,溶液的pH=_____________。
II.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A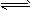 H++HA- HA-
H++HA- HA-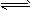 H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)> α(HA-),设有下列四种溶液:
(A)0.01mol/L 的H2A溶液
(B)0.01mol/L 的NaHA溶液
(C)0.01mol/L 的HCl与0.04mol/L的NaHA溶液等体积混合液
(D)0.02mol/L 的NaOH与0.02 mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填代号) :
(5)c(H+)最大的是_ ________,c(H2A)最大的是___________,c(A2-)最大的是_________。
参考答案:(1)H2CO3、CO32-
(2)4.5
(3)HCO3-+H+=H2CO3
(4)10
(5)A;C;D
本题解析:
本题难度:困难
2、选择题 下列叙述不正确的是
A.焰色反应是物理变化
B.在玻璃导管尖嘴处点燃氢气时,由于玻璃中有钠离子,所以火焰带有黄色
C.做焰色反应时铂丝应用稀硫酸洗净,并灼烧至无色
D.在钠和钠的化合物中,钠原子和钠离子的焰色均为黄色
参考答案:C
本题解析:
本题难度:一般
3、选择题 某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,且这四种离子Fe3+、SO42-、Al3+和M的物质的量之比为2∶4∶1∶1,则M离子可能为下列中的
A.Na+
B.I-
C.S2-
D.Cl-
参考答案:D
本题解析:
本题难度:简单
4、填空题 甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含的离子如下表所示:
阳离子
| NH4+、Na+、Mg2+
|
阴离子
| OH-、NO3—、SO42—
|
?
取等质量的三种化合物配制成相同体积的溶液,其溶质的物质的量浓度:c(甲)>c(乙)>c(丙)。
(1)甲是________,向AlCl3溶液中逐滴加入甲溶液,观察到的现象是________,对应的离子方程式为________。
(2)乙是______,设计实验确定乙的物质组成________(若乙已确定,则不填该空)。
参考答案:(1)NaOH 先生成白色沉淀,继续滴加,白色沉淀消失 Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2—+2H2O
(2)(NH4)2SO4或NH4NO3 取乙溶液于小试管中,加入适量BaCl2溶液,若有白色沉淀析出,则乙是(NH4)2SO4,若无明显现象,则乙是NH4NO3
本题解析:甲、乙、丙均是可溶性强电解质,则OH-只能与Na+组成NaOH,三种化合物不含相同离子,所以甲、乙、丙有两种组合(括号里数字表示相对分子质量),第一组:NaOH(40)、(NH4)2SO4(132)、Mg(NO3)2(148);第二组:NaOH(40)、NH4NO3(80)、MgSO4(120),根据溶质质量相等、溶液体积相等以及物质的量浓度大小关系判断,相对分子质量:Mr(丙)>Mr(乙)>Mr(甲),则乙可能是硫酸铵或硝酸铵。
本题难度:一般
5、选择题 碱溶液中都含有OH-,因此不同的碱表现出一些共同的性质.下列关于Ba(OH)2性质的描述中不属于碱的共同性质的是( )
A.能使紫色石蕊试液变蓝色
B.能与盐酸反应生成水
C.能与Na2S04溶液反应生成BaS04沉淀
D.能与CO2反应生成水
参考答案:A、碱均可以使紫色石蕊试液变蓝色,故A不选;
B、碱均可以和盐酸反应生成盐和水,故B不选;
C、能与Na2S04溶液反应生成BaS04沉淀的碱必须是符合复分解反应发生要求的碱,但是氢氧化钠等就不可以,故C选;
D、碱均可以与酸性氧化物CO2反应生成盐和水,故D不选.
故选C.
本题解析:
本题难度:简单