|
高考化学知识点总结《气体的净化、干燥、吸收与收集》考点预测(2019年强化版)(六)
2019-07-04 01:15:26
【 大 中 小】
|
1、填空题 (9分)向橙色的溴水中撒入足量的镁粉,充分振荡后过滤,溶液呈现___________色,原因是______________________。若向滤液中加入适量的氯水后,溶液呈___________色,原因用离子方程式表示为_________________________。
若向此滤液中加入适量的硝酸银溶液,溶液中有___________生成,原因用离子方程式可表示为_________________________________。
参考答案:无? Mg+Br2====MgBr2?橙? Cl2+2Br-====2Cl-+Br2?浅黄色沉淀? Ag++Br-====AgBr↓
本题解析:本题综合考查溴的有关知识,把知识点分解发散,既能达到良好的学习效果,又适当降低了难度。
本题难度:简单
2、实验题 (8分)
氯化铵是一种重要的化工原料,应用广泛。
(1)实验室通常用NH4Cl固体与Ca(OH)2固体混合共热制取氨气。
写出实验室制取氨气的反应方程式? 。
(2)用浓氯化铵溶液处理的舞台幕布难着火,其原因是?(填字母)。
①幕布的着火点升高?②幕布的质量增加?③氯化铵分解吸收热量,降低了温度
④氯化铵分解产生的气体隔离了部分空气
A.①②
B.③④
C.①③
D.②④
| (3)实验室可用NH4Cl溶液与饱和的NaNO2溶液反应制取纯净的氮气,反应方程式为:
NaNO2+NH4Cl NaCl+N2↑+2H2O实验装置如图所示,试回答: NaCl+N2↑+2H2O实验装置如图所示,试回答:
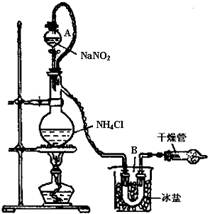
①装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是?(填写编号)。
a.防止饱和溶液蒸发
b.保证实验装置不漏气
c.使饱和NaNO2溶液容易滴下
②加热前必须进行的一个操作步骤是? ?。
参考答案:(1)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O; CaCl2+2NH3↑+2H2O;
(2)B
(3)c;检查气密性
本题解析:考查气体的制取
(1)实验室通常用铵盐及碱来制取氨气:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O; CaCl2+2NH3↑+2H2O;
(2)考查燃烧的必备条件;
通过反应NH4Cl NH3↑+H2O分解吸收热量,降低温度,使幕布达不到着火点;再者分解产生的氨气可隔绝氧气,使其不能燃烧,故选B NH3↑+H2O分解吸收热量,降低温度,使幕布达不到着火点;再者分解产生的氨气可隔绝氧气,使其不能燃烧,故选B
(3)①分液漏斗与蒸馏烧瓶之间连接的导管可平衡两者之间的压强,让反应液易于滴下
②对于制取气体的实验装置,气密性检查必不可少
本题难度:一般
3、填空题 (10分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有右图转化关系(反应条件略去),已知:
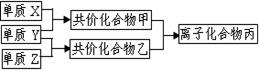
a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是_______________________。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
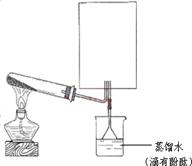
①在图中方框内绘出收集甲的仪器装置简图。
②试管中的试剂是____________________。(填写化学式)
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)_________________________。
 ?(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是__________。 ?(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是__________。
参考答案:(1) 。(2)① 。(2)① ;②Ca(OH)2和NH4Cl。③NH3·H2O ;②Ca(OH)2和NH4Cl。③NH3·H2O NH4++OH-。(3)PCl5。 NH4++OH-。(3)PCl5。
本题解析:略
本题难度:简单
4、实验题 硫酸亚铁的制备实验
要求:设计制备硫酸亚铁的实验方案
仅提供试剂是:含有油污及杂质(铁红或碳粉)的铁粉及10 mL 3 mlo/L H2SO4
实验目的:选择并评价硫酸亚铁制备的途径,进一步了解混合物分离的方法
反应原理:铁与硫酸反应制取硫酸亚铁
实验用品:
实验步骤:
实验现象记录及结果处理:
思考与讨论:
(1)为什么选用了3mol/L H2SO4溶液,而不用浓度更大一点的?(提示:可考虑硫酸亚铁在常温下的溶解度)
(2)为什么要乘热过滤?
(提示:要考虑硫酸亚铁在不同温度下的溶解度)
(3)你认为在实验操作中的固-液分离有几种,具体适合于哪些情况?
参考答案:
实验用品:50mL烧杯2只、玻璃棒、量筒、长颈漏斗、酒精灯、胶头滴管、火柴、滤纸2张、铁架台、铁圈、石棉网、托盘天平、铁粉、3mol/L H2SO4
实验步骤:
(1)称量与清洗:用托盘天平称取含有杂质的铁粉2g,置于50mL烧杯之中,加入10mL左右的稀氢氧化钠溶液,搅拌并加热至沸,稍冷、沉降,倾倒去上层清液,再加入蒸馏水20mL左右,搅拌、沉降,倾倒去上层清液。反复多次,直至溶液呈中性。
(2)生成硫酸亚铁:在上述烧杯中加入10mL 3mol/L H2SO4溶液,让铁粉与硫酸充分反应,可用酒精灯微微加热,充分反应约20分钟。
(3)趁热过滤:将上述溶液乘热过滤(动作要快。为什么?),得到硫酸亚铁的过饱和溶液,冷却至室温,得到硫酸亚铁的晶体。
(4)获取晶体:将操作3所得混合物再一次过滤,并用蒸馏水洗涤2-3次,可得到硫酸亚铁的晶体。
(5)实验结束工作完成。
实验现象记录及结果处理:(1)理论上可获得晶体的质量(2)实际获得的晶体的质量(3)存在误差的原因分析
本题解析:考察实验过程的掌握。实验用品:50mL烧杯2只、玻璃棒、量筒、长颈漏斗、酒精灯、胶头滴管、火柴、滤纸2张、铁架台、铁圈、石棉网、托盘天平、铁粉、3mol/L H2SO4
实验步骤:
(1)称量与清洗:用托盘天平称取含有杂质的铁粉2g,置于50mL烧杯之中,加入10mL左右的稀氢氧化钠溶液,搅拌并加热至沸,稍冷、沉降,倾倒去上层清液,再加入蒸馏水20mL左右,搅拌、沉降,倾倒去上层清液。反复多次,直至溶液呈中性。
(2)生成硫酸亚铁:在上述烧杯中加入10mL 3mol/L H2SO4溶液,让铁粉与硫酸充分反应,可用酒精灯微微加热,充分反应约20分钟。
(3)趁热过滤:将上述溶液乘热过滤(动作要快。为什么?),得到硫酸亚铁的过饱和溶液,冷却至室温,得到硫酸亚铁的晶体。
(4)获取晶体:将操作3所得混合物再一次过滤,并用蒸馏水洗涤2-3次,可得到硫酸亚铁的晶体。
(5)实验结束工作完成。
实验现象记录及结果处理:(1)理论上可获得晶体的质量(2)实际获得的晶体的质量(3)存在误差的原因分析
本题难度:一般
5、填空题 下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是
A.SO2、H2S、Cl2
B.SO2、O2、NH3
C.SO2、CO2、O2
D.HCl、H2S、HI
参考答案:C
本题解析:A中三者不能共存(因:SO2+2H2S=3S+2H2O H2S+Cl2=S+2HCl),且H2S不能用浓硫酸干燥(因H2S具还原性,浓硫酸有强氧化性,所以H2S能被浓硫酸氧化);
B中SO2、NH3不能共存(因两者能发生反应),NH3不能用浓硫酸干燥(因2NH3+H2SO4=(NH4)2SO4);
D中三者能共存,但H2S、HI不能用浓硫酸干燥(原因同A,发生氧化还原反应);
本题难度:一般
|  NaCl+N2↑+2H2O实验装置如图所示,试回答:
NaCl+N2↑+2H2O实验装置如图所示,试回答: