1、选择题 工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的危害,必须进行处理。下面是一种处理方法的工业流程:
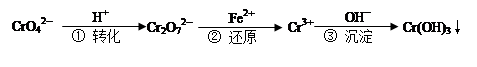
下列说法正确的是:
A.改变反应①的平衡体系中c(H+)浓度,溶液颜色无明显变化
B.若2v (Cr2O72—) ="v" (CrO42—),说明反应①达平衡状态
C.反应②中还原1mol Cr2O72—,需要6 mol的Fe2+
D.FeSO4溶液呈酸性的原因是Fe2++ 2H2O  Fe(OH) 2↓+ 2H+
Fe(OH) 2↓+ 2H+
参考答案:C
本题解析:依据化学平衡影响因素分析,氢离子浓度增大平衡正向进行,溶液颜色发生变化,变橙色,氢离子浓度减小平衡逆向进行,溶液呈黄色,故A错误;化学反应速率之比等于化学方程式中计量数之比,是正反应速率之比,不能证明反应达到平衡,故B错误;依据氧化还原反应电子守恒计算,Cr2O72-,~2Cr3+~6e-;Fe2+~Fe3+~e-,还原1mol Cr2O72-,需要6mol的Fe2+,故C正确;亚铁离子水解程度微弱不能生成氢氧化亚铁沉淀,反应过程是可逆反应,反应的离子方程式为:Fe2++2H2O?Fe(OH)2+2H+,故D错误,故选C。
本题难度:一般
2、选择题 火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2下列说法正确的是
A.SO2只是氧化产物
B.CuFeS2仅作还原剂,硫元素被氧化
C.每生成1molCu2S,有4mol硫被氧化
D.每转移1.2mol电子,有0.2mol硫被氧化
参考答案:D
本题解析:依题意知,Cu从+2价降低为Cu2S中+1价,S从-2价升高到SO2中的+4价;氧元素化合价降低。SO2既是氧化产物又是还原产物;CuFeS2既是氧化剂又是还原剂;每生成1 molCu2S,有1mol硫被氧化。S元素由-2价升高到+4价,该反应中转移电子数是6,所以每转移1.2 mol电子,则有0.2 mol硫被氧化,故D正确;
本题难度:一般
3、选择题 已知:Cl2+2I-=2Cl-+I2;Cl2+2Br-=2Cl-+Br2;Br2+2I-=2Br-+I2。某溶液中Cl-、Br-、I-离子的物质的量之比为2:3:6。欲使溶液中三种离子比例变为6:3:2,则要通入Cl2物质的量与原溶液中Br-物质的量之比为
A.1:3
B.3:1
C.2:3
D.3:2
参考答案:C
本题解析:反应后体系中还有I-离子,再根据已知离子方程式,说明还原性最强的I-离子都没反应完,则其他离子都没有反应。设原体系中Cl-、Br-、I-离子的物质的量分别为2mol,3mol ,6 mol,则反应后有6 molCl-离子, 3molBr-离子,2molI-离子,比较得知Cl-离子又生成了4mol,则需要2mol氯气,所以通入Cl2物质的量与原溶液中Br-物质的量之比为2:3
本题难度:一般
4、选择题 M2O7x-与S2-在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中M元素的化合价为?
A.+2
B.+3
C.+4
D.+6
参考答案:D
本题解析:根据电子守恒:设M2O7x-中M为+y价,得电子总数:(y-3)×2,失电子总数,3×2=6,则(y-3)×2=6,所以y=6,即M为+6价。
根据电荷守恒:方程右边,2×3=6(个正电荷);方程左边,14-(x+3×2)(个正电荷)。则14-(x-6)=6,得x=2。所以,M2O7x-为M2O72-,M的化合价为+6价。
本题难度:一般
5、选择题 已知K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾。那么BaO2的名称是( )
A.氧化钡
B.过氧化钡
C.超氧化钡
D.无法确定
参考答案:B
本题解析:因钾只有+1价,故K2O、K2O2、KO2中的阴离子分别为O2—、O22—、O2—,BaO2中钡为+2价,阴离子为O22—。将K2O2中的K22+代换为Ba2+即得BaO2,那么BaO2的名称应为过氧化钡。
本题难度:简单