1、简答题 为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a?g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000 mol?L-1的KMnO4溶液滴定,达到终点时消耗了25.00mL?KMnO4溶液.
请回答下列问题:
(1)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
______KMnO4+______FeSO4+______H2SO4=______Fe2(SO4)3+______MnSO4+______K2SO4+______H2O
(2)在滴定实验中不能选择______式滴定管,理由是______;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为______和______;(铁的相对原子质量以55.9计)
(4)高锰酸钾是化学中常用强氧化剂.在实验室中可用下式配制少量高锰酸钾溶液:
______Mn2++______NaBiO3+______H+=______MnO4-+______Bi3++______Na++______H2O
1)、配平系数
2)、根据以上信息,下列各组离子在溶液中不能大量共存的是______
A.Na+、K+、H+、Cl-、NO3-、MnO4-?B.Na+、K+、H+、SO42-、BiO3-、Cl-
C.Na+、Al3+、H+、NO3-、SO42-、MnO4-?D.Na+、K+、Mn2+、NO3-、SO42-、Cl-.
2、选择题 铁氧磁体法处理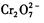 的废水的原理可概述为:向
的废水的原理可概述为:向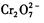 的酸性废水中加人FeSO4·7H2O ,将
的酸性废水中加人FeSO4·7H2O ,将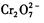 还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢXCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol
还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢXCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol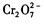 的废水至少需要加人amol FeSO4·7H2O?。下列结论正确的是?(?)
的废水至少需要加人amol FeSO4·7H2O?。下列结论正确的是?(?)
A.x= 0.5 , a=" 8"
B.x = 0.5 , a="10"
C.x = 1.5 , a=" 8"
D.x = 1.5 , a= 10
3、填空题 在热的稀硫酸中溶解了11.4 g FeSO4固体,当加入50 mL 0.5 mol·L-1 KNO3溶液时,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体。
(1)推算出x= ;y= 。
(2)配平该反应的方程式:
FeSO4+ KNO3+ H2SO4= K2SO4+ Fe2(SO4)3+  (NxOy)+ H2O(配平时x、y用具体数值表示,物质填在
(NxOy)+ H2O(配平时x、y用具体数值表示,物质填在 中)。
中)。
(3)反应中氧化产物是 。
(4)用双线桥法表示该反应中的电子转移方向和数目: 。
4、选择题 向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法不正确的是(?)
A.Cu与Cu2O的物质的量之比为2∶1
B.硝酸的物质的量浓度为2.6 mol·L-1
C.产生的NO在标准状况下的体积为4.48 L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol
5、选择题 已知某金属硝酸盐,在受热分解时生成了金属氧化物、二氧化氮与氧气。得到的二氧化氮与氧气通入水中,恰好被水完全吸收,试分析该硝酸盐分解时金属化合价的变化情况是(? )?
A.升高
B.降低
C.不变
D.不能确定