1、选择题 NaClO2可用作造纸的漂白剂,它由H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2制得,下列说法正确的是
A.H2O2是氧化剂,H2O2中的氧元素被还原
B.每生成1 mol O2转移的电子的物质的量为4 mol
C.ClO2中的氯元素被氧化
D.ClO2是氧化剂,H2O2是还原剂
参考答案:D
本题解析:A、根据方程式可知,双氧水中氧元素的化合价从-1价升高到0价,失去电子被氧化,双氧水是还原剂,A不正确;B、双氧水中氧元素的化合价从-1价升高到0价,失去1个电子,因此每生成1 mol O2转移的电子的物质的量为2mol,B不正确;C、ClO2中的氯元素化合价从+4价降低到+3价,得到1个电子被还原,C不正确;D、根据以上分析可知,ClO2是氧化剂,H2O2是还原剂,D正确,答案选D。
本题难度:一般
2、填空题 在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol·L-1。
(1)稀释后的溶液pH=?;
(2)若a=9,则生成的气体中NO2的物质的量为?mol。
参考答案:(1)0?(2)0.125
本题解析:(1)因为铜全部溶解,因此溶液中铜离子的物质的量为0.1 mol,那么与铜离子相结合的硝酸根离子的物质的量为0.2 mol。又因为溶液中总的硝酸根离子的物质的量为0.3 mol,所以以硝酸形式存在的离子的物质的量为0.1 mol,也可以理解为溶液中剩余硝酸的物质的量为0.1 mol,那么硝酸的浓度为1mol·L-1,所以其pH=0。(2)若a=9,则题中所提供的硝酸总的物质的量为0.45 mol,减去剩余的0.3mol,那么被还原的硝酸的物质的量为0.15 mol。因为这是一个氧化还原反应,氧化剂所得到的电子与还原剂所失去的电子的物质的量相等,还原剂铜所失去的电子一定为0.2mol,假设反应中生成的二氧化氮的物质的量为x mol, 那么一氧化氮的物质的量就为:(0.15-x)mol,如是有如下关系:
0.2=(0.15-x)×3+x,解之得:x="0.125" mol
本题难度:一般
3、选择题 为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法不正确的是(?)
A.NaClO溶液的消毒原理是使蛋白质变性
B.1 mol Cl2与足量NaOH溶液反应转移2 mol电子
C.NaClO溶液的漂白原理与Na2O2相同,与SO2不同
D.“84”消毒液与“洁厕灵”(盐酸)混合使用可能会产生有毒的氯气
参考答案:B
本题解析:NaClO具有强氧化性,能使蛋白质变性,A对;在反应Cl2+2NaOH=NaCl+NaClO+H2O中氯气既是氧化剂,又是还原剂,1 mol Cl2参加反应转移1 mol电子,B错;NaClO、Na2O2具有强氧化性而漂白,SO2与有色物质化合而漂白,C对;NaClO具有强氧化性,“洁厕灵”中的盐酸具有还原性,会发生反应NaClO+2HCl=NaCl+Cl2↑+H2O,D对。
本题难度:一般
4、选择题 做好环境消毒工作是预防“禽流感”的重要措施,常用的一种消毒剂是ClO2,实验室可通过以下反应制得ClO2(未配平):KClO3+H2C2O4+H2SO4―→ClO2↑+K2SO4+CO2↑+H2O。下列说法正确的是( )
A.H2SO4在反应中作氧化剂
B.ClO2是氧化产物
C.H2C2O4在反应中被氧化
D.1 mol KClO3参加反应时有2 mol电子转移
参考答案:C
本题解析:A项,硫酸既不是氧化剂也不是还原剂,错误。B项,反应前后氯元素化合价降低,ClO2是还原产物,错误。D项,1 mol KClO3参加反应时有1 mol电子转移,错误。
本题难度:一般
5、选择题 将一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)="0.1" mol/L,则下列叙述中错误的是(?)
A.反应中消耗的Zn的质量为97.5 g
B.气体A中SO2和H2的体积比为1∶4
C.反应中被还原的元素只有一种
D.反应中共转移电子3 mol
参考答案:C
本题解析:解答本题应注意以下两点:
(1)生成的33.6 L气体可能是SO2和H2的混合气体。
(2)假设反应的Zn一部分还原出SO2,一部分还原出H2,设未知数、列方程式计算。
设气体A中SO2、H2的物质的量分别为x、y。
则根据两个反应方程式可知
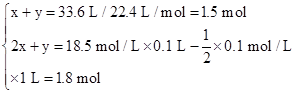
解得x="0.3" mol? y="1.2" mol
消耗Zn的质量为(x+y)×65 g/mol="97.5" g,转移电子数为3 mol,被还原的元素有S、H两种。
本题难度:一般