1、选择题 将69 g NO2(含少量N2O4)通入水中,关于此过程下列说法正确的是(NA表示阿伏加德罗常数)
A.69 g NO2与N2O4混合气体所含原子数介于4.5 NA至9.0 NA之间
B.此反应中转移的电子数为NA
C.最终可收集到11.2 L无色气体
D.若将所得硝酸制成浓硝酸,常温下最多可溶解0.25 mol铁。
2、选择题 在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol/L、
0.1 mol/L,向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度是(?)
A.0.15 mol/L
B.0.225 mol/L
C.0.30 mol/L
D.0.45 mol/L
3、填空题 亚硫酸 钠和碘酸钾在酸性溶液中发生以下发应:
钠和碘酸钾在酸性溶液中发生以下发应:
?Na2SO3+?KIO3+?H2SO4 → __Na2SO4 +?K2SO4+?I2 +?
(1)配平上面的方程式,在横线上填入系数,在方框填上反应产物
(2)其中氧化剂是?,若反应中有2.5mol电子转移,则生成的碘是?mol;氧化产物为?mol。
(3)该反应的过程和机理较复杂,一般认为发生以下四步反应:
①? IO3- +SO32 -? ?IO2-? + SO42 -? (反应速率慢)
?IO2-? + SO42 -? (反应速率慢)
②? IO2- + 2SO32 -? ?I- + 2SO42 -? (反应速率快)
?I- + 2SO42 -? (反应速率快)
③? 5I- +6H+ +IO3- 3I2 +3H2O?(反应速率快)
3I2 +3H2O?(反应速率快)
④? I2 +SO32 - +H2O? ?I- + SO42 -+2H+?(反应速率快)
?I- + SO42 -+2H+?(反应速率快)
根据上述步骤推测该反应总的反应速率由_____(填反应编号)步反应决定。
(4)预先加入淀粉溶液,由上述四步反应可以看出必须在_____离子消耗完后,才会使淀粉变蓝的现象产生。
4、填空题 向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,震荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是l,不用填写): ___口+___口+___口→__HIO3+__口
(2)整个过程中的还原剂是______。
(3)把KI换成KBr,则CCl4层变为____色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是_________。
?(4)加碘盐中含碘量为20 mg-50 mg/kg。制取加碘盐(含KIO3的食盐)1000 kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2_____L(标准状况,保留2位小数)。
5、填空题 工业上利用含有一定浓度的I2和CuSO4溶液的工业废水制备饲料添加剂Ca(IO3)2,其生产流程如下:
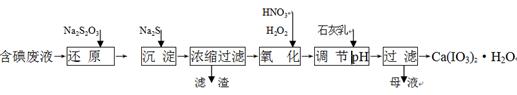
已知:Ca(IO3)2微溶于水,溶于硝酸;Ksp(CuI)=1.1×10-12, Ksp(Cu2S)=2.5×10-48;
氧化性: HNO3>IO3—>H2O2
(1)“还原”过程中主要反应的化学方程式为:2Na2S2O3+I2 = + 2NaI。
(2)在还原过程还伴随有CuI生成,写出加入Na2S的离子反应方程式 。
(3)在氧化过程中先加入H2O2再加入浓硝酸,而不直接加入浓硝酸的目的是 。
(4)加入的石灰乳在溶液中反应而得到Ca(IO3)2,则要调节pH至 (填“酸性” 或“中性”或“碱性”),原因是 。
(5)Ca(IO3)2也可用电化学氧化法制取:先充分电解KI溶液,然后在电解后的溶液中加入CaCl2,最后过滤得到Ca(IO3)2。写出电解时阳极发生的电极反应方程式 ,用该方法制取Ca(IO3)2,每1kg碘化钾理论上可生产纯度为97.8%Ca(IO3)2的质量为 ____kg(计算结果保留3位有效数字)。