1、选择题 人体正常血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化为Fe3+而中毒,服用维生素C可以解毒。对上述事实分析正确的是(?)
A.亚硝酸盐是还原剂
B.维生素C是氧化剂
C.亚硝酸盐将Fe3+还原成Fe2+
D.维生素C被Fe3+氧化
参考答案:D
本题解析:略
本题难度:一般
2、填空题 亚铁盐在空气中易被氧化,但形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]是一种重要化学试剂,实验室可用纯铁片来制取硫酸亚铁铵,流程如下:
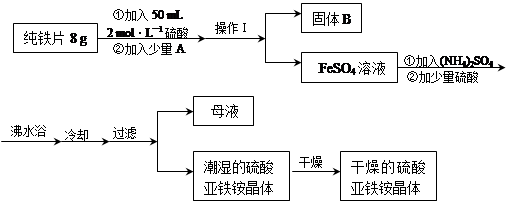
请回答下列问题:
(1)操作Ⅰ的名称是 ?,所用主要仪器和用品有(铁架台、铁圈除外)?。
(2)若A物质为CuSO4,其加入的目的是??,则固体B的成分为?。
(3)加少量硫酸可以调节pH为 1~2,其作用是?。
参考答案:(1)过滤,(1分) 滤纸、漏斗、玻璃棒、烧杯(1分)
(2)加快铁片与硫酸的反应速率(1分)(其他合理答案也可)? Fe和Cu(2分)
(3)抑制Fe2+、NH4+水解(2分)
本题解析:(1)根据题给工艺流程分析,操作Ⅰ为分离固液混合物的操作,名称是过滤,所用主要仪器和用品有(铁架台、铁圈除外)滤纸、漏斗、玻璃棒、烧杯;(2)若A物质为CuSO4,加入后和铁发生反应生成铜析出,和铁在硫酸溶液中形成原电池反应加快铁片与硫酸的反应速率,过滤得到固体B的成分为铁和铜的混合物;(3)加少量硫酸可以调节pH为 1~2,其作用是其加入的目的是抑制亚铁离子和铵根离子水解,得到更多的产品。
本题难度:一般
3、简答题 含铁元素的物质有很多,它们对人体健康、生产生活都有重要作用,请完成以下填空:
(1)指出下列化合物中铁元素的化合价(O均为-2价):Fe(OH)2______?Fe2O3______?Na2FeO4______
(2)取少量某品牌油漆的原料Fe2O3(红棕色粉末)并加入适量盐酸,反应后得到棕黄色FeCl3溶液,取少量棕黄色溶液置于试管中,滴入NaOH溶液,可观察到Fe(OH)3沉淀生成,生成沉淀的离子方程式为______.另在小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL?上述棕黄色溶液,继续加热至______色液体,停止加热,用______物理方法证明所得分散系的类别,写出制备该分散系的化学方程式______.
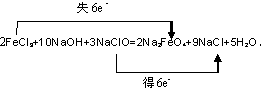
(3)高铁酸钠(Na2FeO4)能有效地杀灭水中的病菌.工业制备Na2FeO4的化学方程式:
2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O(O均为-2价),请用双线桥表示该反应的电子转移方向和总数______.
(4)一个体重50kg的健康人含铁元素2g,Fe2+易被人体吸收,所以给贫血者补充铁时,服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.维生素C在这个反应中表现______(“氧化性”“还原性”).
参考答案:(1)化合物中各元素的化合价的代数和为0,所以Fe(OH)2?中,氢氧根离子显-1价,所以铁元素显+2价;
?Fe2O3?中氧元素显-2价,所以铁元素显+3价;?Na2FeO4中,钠元素显+1价,氧元素显-2价,所以铁元素显+6价.
故答案为:+2;+3;+6.
(2)根据题意知,反应物是氢氧化钠和氯化铁,生成物是氢氧化铁沉淀,所以离子方程式为:Fe3++3OH-═Fe(OH)3↓;向沸水中滴加氯化铁溶液可制得红褐色氢氧化铁胶体,
离子反应为Fe3++3H2O(沸水)═Fe(OH)3(胶体)+3H+,氢氧化铁胶体具有丁达尔效应.
故答案为:Fe3++3OH-═Fe(OH)3↓;红褐色;丁达尔效应;Fe3++3H2O(沸水)═Fe(OH)3(胶体)+3H+;
(3)2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,该方程式中,一个铁原子由+3价失3个电子变成+6价,2个铁原子失去6个电子,NaClO中的Cl元素的原子得2个电子,3个Cl原子得6个电子,所以转移电子数为6.
故答案为:
(4)Fe3+转化成Fe2+,Fe3+体现氧化性,在氧化还原反应中,氧化剂和还原剂同时存在,服用维生素C可使食物中的Fe3+转化成Fe2+,所以维生素C体现还原性.
故答案为:还原性.
本题解析:
本题难度:一般
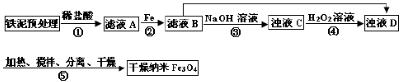
4、填空题 某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下:
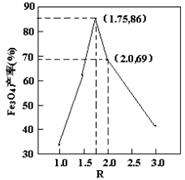
已知:R= ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
(1)步骤②中,主要反应的离子方程式是______。
(2)已知:Fe3+在pH=2.8时沉淀完全; Fe2+在pH=6.3时开始沉淀,在pH=8.3时沉淀完全。
步骤③中,用NaOH溶液调pH至9,原因是______。
(3)浊液D中铁元素以FeOOH形式存在。步骤④中,反应的化学方程式是______。
(4)下列说法正确的是______(选填字母)。
a.步骤④中,当反应完成后需再加热一段时间
b.步骤⑤中,反应过程中需要不断补充碱液
c.步骤⑤恰好反应时,n(FeOOH)/n(Fe2+)="2:1"
d.当n(浊液D中FeOOH)/n(滤液B中的铁元素)=4/7时,Fe3O4的产率最高
参考答案:(1)2Fe3++Fe=3Fe2+
(2)使亚铁离子沉淀完全
(3)2Fe(OH)2+H2O2=2FeOOH+2H2O
(4)a b c
本题解析:(1)滤液A中含有Fe3+,加入Fe后发生反应:2Fe3++Fe=3Fe2+
(2)Fe2+在pH=8.3时沉淀完全,所以步骤③中,用NaOH溶液调pH至9,亚铁离子沉淀完全。
(3)浊液C含有Fe(OH)2,加入H2O2,发生氧化还原反应,生成FeOOH,化学方程式为:2Fe(OH)2+H2O2=2FeOOH+2H2O。
(4)a、步骤④中,当反应完成后需再加热一段时间,可除去剩余的H2O2,正确;b、步骤⑤发生的反应为:2FeOOH+Fe2++2OH?=Fe3O4+2H2O,消耗OH?,所以需要不断补充碱液,正确;c、步骤⑤恰好反应时,生成Fe3O4,+3价的Fe与+2价的Fe物质的量之比为2:1,所以n(FeOOH)/n(Fe2+)=2:1,正确;d、根据图像可知,Fe3O4的产率最高时,+3价Fe与+2价Fe物质的量之比为1.75,所以当n(浊液D中FeOOH)/n(滤液B中的铁元素)=4/7时,Fe3O4的产率不是最高,错误。
本题难度:一般
5、选择题 下列物质能将Fe3+转化为Fe2+的有(?)
①新制氯水?②铁?③铜?④稀硫酸
A.①②③
B.③④
C.②③
D.①②③④
参考答案:C
本题解析:将三价铁转化为二价铁应选择还原剂铁或铜。
点评:新制氯水有氧化性,能将Fe2+氧化为Fe3+;Fe3+转化为Fe2+可用还原剂S2-、I-、H2S、SO2、SO32-、Zn、Cu、Fe等。
本题难度:一般