1、实验题 (12分)NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
________________________________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
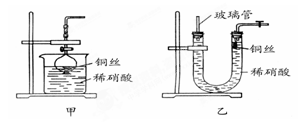
打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是_________________________________(写化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始时,可以在U形管右端观察到无色的NO气体。长玻璃管的作用是_______________________________________。
(4)假设实验中12.8 g Cu全部溶解,需要通入标准状况下________L O2才能使NO全部溶于水。
(5)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”“乙”“丙”或“丁”),理由是__________________________________。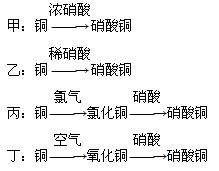
参考答案:(1)3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑?(2)2NO+O2=2NO2
(3)接收被气体压出U形管的液体,防止稀硝酸溢出?(4)2.24L
(5)?丁?制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体? (每空2分,共12分)
本题解析:(1)硝酸是氧化性酸,和铜反应的方程式为3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑。
(2)NO极易被氧气氧化生成红棕色的NO2,方程式为2NO+O2=2NO2。
(3)由于反应中生成的NO难溶于水,导致压强增大,所以长玻璃导管的作用是接收被气体压出U形管的液体,防止稀硝酸溢出。
(4)12.8g铜是0.2mol,失去电子是0.4mol;由于最终NO又生成硝酸,说明铜失去的电子被氧气得到,根据电子的得失守恒可知,氧气的物质的量是0.1mol,标准状况下的体积是2.24L。
(5)甲乙中均产生大气污染物,丙中原子利用率不高,且氯气有毒,所以正确的答案选丁。
本题难度:一般
2、选择题 下列反应起了氮的固定作用是(?)
A.N2和H2在一定条件下反应生成NH3
B.NH3经催化氧化生成NO
C.NO与O2反应生成NO2
D.由NH3制碳铵或硫铵
参考答案:A
本题解析:游离态的氮转化为化合态的氮的过程属于氮的固定,所以选项A正确,其余都是错误的。答案选A。
本题难度:简单
3、填空题 (6分)下列事实反映了硝酸的什么性质:①不稳定性②强氧化性③强酸性
⑴硝酸应贮存在棕色试剂瓶中 ;⑵Ag与稀硝酸作用制取AgNO3 ;⑶可用稀硝酸与CaCO3作用制取CO2。
参考答案:⑴.① ⑵②③⑶③
本题解析:略
本题难度:简单
4、选择题 由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是(?)
A.Mg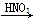 Mg(NO3)2
Mg(NO3)2
B.Mg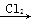 MgCl2
MgCl2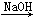 Mg(OH)2
Mg(OH)2 Mg(NO3)2
Mg(NO3)2
C.Mg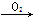 MgO
MgO Mg(NO3)2
Mg(NO3)2
D.Mg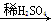 MgSO4
MgSO4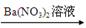 Mg(NO3)2
Mg(NO3)2
参考答案:C
本题解析:该法耗用的原料少且不产生污染物。
本题难度:一般
5、选择题 某同学利用如图所示装置进行实验,一段时间后,水沿导管缓慢上升。下列说法错误的是( )。

A.实验过程中气球体积会发生变化
B.广口瓶中液体的pH减小
C.广口瓶中有化合反应发生
D.试管中不可能发生分解反应
参考答案:D
本题解析:铜与浓硝酸反应生成的NO2气体进入广口瓶中,与水反应生成NO,NO可能再与水上方的O2化合生成NO2,气体进入气球使其体积变大;广口瓶中有硝酸生成,液体的pH减小;试管中有浓硝酸,有可能发生浓硝酸的分解反应。
本题难度:一般