1、填空题 (14分)氢是一种重要的非金属元素。氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用。
(1)某硝酸厂处理尾气中NO的方法是:催化剂存在时用H2将NO还原为N2。
已知:
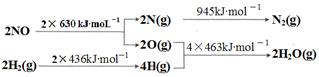
则H2还原NO生成氮气和水蒸气的热化学方程式是:
?。
(2)在一定条件下,用H2将二氧化碳转化为甲烷的反应如下:来源:91考试网 91eXAm.org
CO2(g)+4H2 (g)  CH4 (g)+2H2O(g)
CH4 (g)+2H2O(g)
向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2mol·L一1,H2 0.8mol·L一1,CH40.8mol·L一1,H2O1.6mol·L一1。则CO2的平衡转化率为?。上述反应的平衡常数表达式K=?。200℃时该反应的平衡常数K=64.8,则该反应的△H?0(填“>’’或“<”)。
(3)某研究小组以H2与CaCl2制备某种钙的化合物。已知反应只生成甲、乙两种化合物。对产物分析发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为?。
②甲与水反应可得H2,其化学方程式是:
?。
(4)H2的获得途径很多,由哈工大研究小组设计的微生物电解有机废水法,既可以清除废水中的有机杂质,同时可以获得氢气。下图为一种处理含甲醇工业废水的微生物电解池,写出电解过程中,阳极发生的电极反应式:?。

参考答案:(1)2NO(g) +2H2(g)=N2(g) + 2H2O(g)?△H=-665kJ·moL-1(2分)
(2)80%; c(CH4)·c2(H2O)/c(CO2)·c4(H2);<?(各2分)
(3)①HCl(2分)?②2CaHCl + 2H2O=CaCl2 + Ca(OH)2 + 2H2↑(3分)
(4)CH3OH-6e—+H2O=CO2↑+6H+
本题解析:(1)首先写出H2还原NO生成氮气和水蒸气的化学方程式并注明状态:2NO(g) +2H2(g)=N2(g) + 2H2O(g),然后根据键能求出焓变,?H=2×630kJ?mol?1+2×436kJ?mol?1—945kJ?mol?1—4×463kJ?mol?1=-665kJ·moL-1,可得热化学方程式。
(2)设起始时CO2和H2的物质的量浓度分别为x、y;
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始浓度(mol?L?1) x? y? 0? 0
变化浓度(mol?L?1) 0.8?3.2? 0.8? 1.6?
平衡浓度(mol?L?1) 0.2? 0.8?0.8?1.6
x=0.8mol?L?1 +0.2mol?L?1 =1mol?L?1,y=3.2mol?L?1 +0.8mol?L?1 =4mol/L;
CO2的平衡转化率=0.8mol?L?1÷1mol?L?1×100%=80%;根据平衡常数的含义可知平衡常数表达式K= c(CH4)·c2(H2O)/c(CO2)·c4(H2);300℃时平衡常数为:0.8×1.62?÷(0.2×0.84)=25,200℃时该反应的平衡常数K=64.8,说明温度升高,平衡常数减小,平衡向逆反应方向移动,则该反应为放热反应,?H<0。
(3)①化合物乙的水溶液显酸性,根据元素守恒知乙为氯化氢。
②化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,还有一种元素,根据反应中元素守恒知,另一种元素为氢元素,则其钙原子、氯原子和氢原子个数之比=52.29%/40:46.41%/35.5:(1-52.29%-46.41%)/1=1:1:1,所以所以甲的化学式为CaHCl,甲和水反应生成氢气,同时生成氯化钙、氢氧化钙,反应方程式为:2CaHCl+2H2O=CaCl2+Ca(OH)2+2H2↑
(4)阳极上发生CH3OH失电子反应,电极方程式为:CH3OH-6e—+H2O=CO2↑+6H+
本题难度:一般
2、选择题 某温度下,某容积恒定的密闭容器中发生如下可逆反应
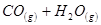

 ? △H
? △H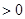
当反应达平衡时,测得容器中各物质均为 ,欲使
,欲使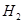 的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
A.升高温度
B.再加入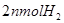
C.再加入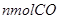 和
和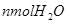
D.再加入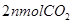 和
和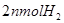
参考答案:D
本题解析:达到平衡,各物质均为nmol,即起始的CO和H2O分别为2nmol,该反应为恒温恒容体积不变的反应,只要成比例,就可以建立等比的等效平衡。故答案选D。
本题难度:一般
3、选择题 在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g)  3C(g)? ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是(? )
3C(g)? ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是(? )
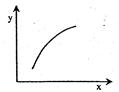
选项
| x
| y
|
A
| 降温
| A的体积分数
|
B
| 升高温度
| 混合气体的密度
|
C
| 再加入A
| B的转化率
|
D
| 再加入C
| A的体积分数
|
?
参考答案:C
本题解析:A、该反应为放热反应,降温平衡向右移动,A的体积分数减小,错误;B、根据质量守恒定律,气体总质量不变,容器的体积固定,所以混合气体的密度为定值,错误;C、再加入A,B的转化率增大,正确;D、再加入C,因为反应前后气体的系数相等,所以A的体积分数不变,错误。
本题难度:一般
4、选择题 巳知2X(g)+Y(g)?mZ(g);△H=-akJ/mol(a>0).现有甲、乙两容积相等且固定的密闭容器,保持温度不变的条件下,向甲容器中通入2mol?X和1mol?Y,达平衡状态时,放出热量为bkJ,向乙容器中通入1mol?X和0.5mol?Y,达平衡状态时,放出热量为ckJ,且b>2c.则a、b、m的关系可能正确的是( )
A.a=b
B.m=2
C.m=4
D.a<b
参考答案:A、因该反应为可逆反应,a为2molX、1molY反应完全转化时放出的能量,而向密闭容器甲中通入2molX和1molY,不会完全转化,则a>b,故A错误;
B、因为定容,若m<3,乙中压强比甲中压强小,平衡向体积增大方向移动趋势大,逆向移动的趋势大,乙中物质的转化率较小,放出的热量b>2c,与题中热量关系符合,故B正确;
C、因为定容,若m>3,乙中压强比甲中压强小,平衡向体积增大方向移动趋势大,平衡正向移动,乙中物质转化率较大,放出的热量b<2c,与题目中b>2c不符,故C错误;
D、因该反应为可逆反应,a为2molX、1molY反应完全转化时放出的能量,而向密闭容器甲中通入2molX和1molY,不会完全转化,则a>b,故D错误.
故选B.
本题解析:
本题难度:简单
5、选择题 X、Y、Z三种气体,取X和Y按2:1的物质的量之比混合,放入固定体积的密闭容器中发生如下反应:X+2Y?2Z,达到平衡后,X的转化率不可能为( )
A.10%
B.15%
C.20%
D.25%
参考答案:取X和Y按2:1的物质的量之比混合,
? X+2Y?2Z,
开始2? 1
转化0.5 1
则X的转化率为0.52×100%=25%,
则X的转化率不可能为25%,
故选D.
本题解析:
本题难度:简单