1、选择题 对于平衡体系2SO2(g) + O2(g)  2SO3(g);ΔH<0.下列结论中正确的是
2SO3(g);ΔH<0.下列结论中正确的是
A.若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.48倍
B.若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量之比为2:1
C.若从平衡体系中分离出SO3,则有利于提高SO2的转化率和加快正反应速率
D.平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2
2、计算题 一定温度下,向密闭容器中加入等物质的量的SO2和O2,反应达平衡时,SO2的转化率是50%,此时SO3所占的体积分数为多少?
3、选择题 一定条件下,可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol· L-1、0.3mol· L-1、0.08mol· L-1,则下列判断不正确的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol· L-1、0.3mol· L-1、0.08mol· L-1,则下列判断不正确的是
[? ]
A.c1:c2的值不能确定
B.平衡时,Y和Z的生成速率之比为3:2
C.0.28mol·L-1<c1+c2+c3<0.56mol·L-1?
D.c1的取值范围为0<c1<0.14 mol·L-1
4、填空题 (10分)在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:
 3A(g)+B(g)? 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白。
3A(g)+B(g)? 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白。
⑴B的平衡浓度为?。
⑵A的转化率为?。
⑶用D表示的平均反应速率为?。
⑷如果缩小容器容积(温度不变),则平衡体系中混合气体的密度?、平均相对分子质量?。(两空均填“增大、“减少”或“不变”)
5、选择题 已知某可逆反应aA(g) + bB(g)  ?cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图。下列叙述正确的
?cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图。下列叙述正确的
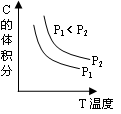
A.正反应为吸热反应
B.降低温度,正反应速率增大
C.a + b < c + d
D.增大压强,B转化率增大