1、选择题 如图,在二个圆底烧瓶中都充满NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:在(1)中加入无水CaCl2,(2)中不加其他任何物质,在(3)中加入NH4Cl晶体。发现:

(1)中红综色变深,(3)中红棕色变浅。下列叙述正确的是(?)
A.CaCl2溶于水时放出热量
B.烧瓶(1)中气体的压强不变
C.NH4Cl溶于水时放出热量
D.烧瓶(3)中气体的压强增大
参考答案:A
本题解析:由于2NO2 N2O4的反应是放热的,颜色加深,说明溶液温度升高,平衡向逆反应方向移动,因此A正确。温度高,压强大,B不正确。颜色变浅,说明平衡向正反应方向移动,因此NH4Cl溶于水时吸收热量,温度低,压强减小,所以选项CD都是错误的,答案选A。
N2O4的反应是放热的,颜色加深,说明溶液温度升高,平衡向逆反应方向移动,因此A正确。温度高,压强大,B不正确。颜色变浅,说明平衡向正反应方向移动,因此NH4Cl溶于水时吸收热量,温度低,压强减小,所以选项CD都是错误的,答案选A。
本题难度:一般
2、选择题 对A+3B=2C+2D来说,下列四种不同情况下的反应速率最快的是
[? ]
A.υ(A)= 0.15 mol/(L·min)
B.υ(B)= 0.6 mol/(L·min)
C.υ(C)= 0.4 mol/(L·min)
D.υ(D)= 0.45 mol/(L·min)
参考答案:D
本题解析:
本题难度:简单
3、选择题 在1 L密闭容器中,充入一定量的A发生反应:A(g) 2B(g)(正反应为放热反应)。当反应达到平衡后,改变影响平衡的一个条件,反应达到新的平衡。右图Ⅰ、Ⅱ两曲线分别表示整个反应过程中两种物质的浓度变化关系。下列说法正确的是(?)
2B(g)(正反应为放热反应)。当反应达到平衡后,改变影响平衡的一个条件,反应达到新的平衡。右图Ⅰ、Ⅱ两曲线分别表示整个反应过程中两种物质的浓度变化关系。下列说法正确的是(?)
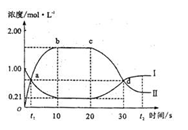
A.a点和d点分别表示两个不同的平衡状态
B.在a点,B的物质的量浓度为0.67 mol/L
C.20s~t2s,表示降低温度使平衡移动的过程
D.0s~10s间,用B表示的反应速率为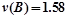 mol/(L·s)
mol/(L·s)
参考答案:B
本题解析:本题考查的是化学平衡的有关内容。
A、a点和d点反应混合物的浓度还在发生变化,不是平衡状态,故A错误;
B、a点时,A、B的浓度相等,A的起始浓度为1mol/L,令a点B的浓度为c,根据方程式A(g)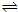 2B(g)可知A的浓度变化为0.5c,所以1mol/L-0.5c=c,解得c=0.67mol/L,故B正确;
2B(g)可知A的浓度变化为0.5c,所以1mol/L-0.5c=c,解得c=0.67mol/L,故B正确;
C、由图可知20s~t2s,B的浓度减小,A的浓度增大.若降低温度使平衡移动,反应为放热反应,降低温度平衡向正反应移动,B的浓度应该增大,A的浓度应增大,故不可能是降低温度,应为升高温度,故C错误;
D、由图可知0s~10s,A的浓度变化为1mol/L-0.21mol/L=0.79mol/L,所以v(A)=
0.79mol/L
10s
0.079mol/(L?mol),速率之比等于化学计量数之比,所以v(B)=2v(A)=2×0.079mol/(L?mol)=0.158mol/(L?mol),故D错误.
故本题选:B.
本题难度:一般
4、选择题 已知298K时,2SO2(g)+O2(g) 2SO3(g);△H=-197KJ/mol。在相同的温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量Q2。则下列关系式正确的是(?)
2SO3(g);△H=-197KJ/mol。在相同的温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量Q2。则下列关系式正确的是(?)
A.Q1=Q2=197KJ
B.Q1<Q2<197KJ
C.Q2<Q1<197KJ
D.Q1=Q2<197KJ
参考答案:C
本题解析:由反应方程式中可以看出,每有2mol的SO2发生反应放出热量为197KJ.但由于该反应是可逆反应,当向密闭容器中通入2molSO2和1molO2时不可能反应完全,所以放出热量要小于197KJ.当向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,就相当与只加入1molSO2、0.5molO2。由于减小反应物浓度,化学平衡逆向移动,放热比第一种情况还少。所以关系式正确的是Q2<Q1<197KJ 。选项为:C。
本题难度:一般
5、选择题 已知真空炼铷的原理如下:2RbCl+Mg = MgCl2+2Rb(g)。对于此反应的进行能给予正确解释的是(? )
A.铷的金属活动性不如镁强,镁可置换出铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡向右移
C.铷的单质状态较化合态更稳定
D.MgCl2的热稳定性不如RbCl强
参考答案:B
本题解析:依据金属活泼顺序知:Rb>Na>Mg,是故A错;结合反应式中产物铷为气态,及时采取措施将铷抽走,使平衡向右移动,这样不断的进行下去,得到大量的铷,故B正确;铷属于活泼性最强的碱金属族,其单质的稳定性差,以化合态的形式存在于自然界中,故C错;MgCl2与RbCl的稳定性应离子键的强弱比较,由于MgCl2的离子键的形成的离子半径小且所带的电荷多,即离子键强,稳定性强,故D错。
本题难度:一般