1、选择题 在2KMnO4 +16HCl ="==" 2KCl +2MnCl2 + 5Cl2↑+8?反应中
A.Cl2是还原产物
B.处对应的物质为H2O
C.氧化剂与还原剂物质的量之比为1∶8
D.若1mol KMnO4参加反应,转移的电子的物质的量是5mol
参考答案:BD
本题解析:考查氧化还原反应的基本知识及配平;
由原子守恒可知,?处对应的物质为H2O;
反应中锰元素全部由+7价降至+2价,若1mol KMnO4参加反应,得到的电子的物质的量是5mol,KMnO4为氧化剂,MnCl2 为还原产物;而HCl 中的部分氯元素由—1价升至0价,失电子,被氧化,HCl做还原剂,氧化产物为Cl2;可见,氧化剂与还原剂物质的量之比为2∶10,即1∶5;
故答案为BD
本题难度:简单
2、简答题 小明做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++□(未配平).关于此反应的叙述正确的是( )
A.该反应的氧化剂是H2C2O4
B.1molMnO4-在反应中失去5mol电子
C.该反应右框内的产物是OH-
D.配平该反应后,H+的计量数是6
参考答案:A、化合价降低的元素是锰元素,所在反应物KMnO4是氧化剂,故A错误;
B、锰元素化合价从+7价降低到+2价,元素得到电子,化合价降低数=得到电子的数目=5,即1molMnO4-在反应中得到5mol电子,故B错误;
C、根据电子守恒,该反应中锰元素化合价降低5价,两碳元素化合价共升高2价,所以反应转移电子数为10,所以可以得到:2MnO4-+5H2C2O4+H+→10CO2↑+2Mn2++□,根据电荷守恒、原子守恒,所以□中为8H2O,H+的计量数是6,故C错误;
D、根据原子守恒、电子守恒和电荷守恒来配平离子方程式为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O,H+的计量数是6,故D正确.
故选D.
本题解析:
本题难度:一般
3、填空题 在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,固体全部溶解,且还原产物只有NO2和NO。将反应后溶液用蒸馏水稀释至100 mL,测得c(NO3-)=4 mol·L-1。
(1)稀释后的溶液中c(H+)=?mol·L-1
(2)若a=10,则生成的气体中NO2的物质的量为________mol
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH=2NaNO2+H2O? 2NO2+2NaOH=NaNO2+NaNO3+H2O
若上述混合气体被1 mol·L-1的NaOH溶液恰好吸收,则NaOH溶液的体积为________mL
参考答案:(1)2?(2)0.05?(3)100
本题解析:(1)在稀释后的溶液中含有Cu(NO3)2、HNO3。根据物料守恒可得n(NO3-)=2n(Cu2+)+n(H+).n(Cu2+)=6.4g÷64g/mol=0.1mol; n(NO3-)="4" mol/L×0.1L=0.4mol。所以n(H+)= 0.4mol-2×0.1mol=0.2mol.稀释后的溶液中c(H+)=n(H+)÷V=0.2mol÷0.1L=2mol/L。(2)若a=10,n(HNO3)(总)=0.05L×10mol/L=0.5molL; 根据n(HNO3)( 剩余)=0.2mol.则反应消耗的硝酸的物质的量为0.3mol.开始的硝酸为浓硝酸,发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。,随着反应的进行 硝酸变为稀硝酸,发生反应: 3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O假设产生的NO2、NO的物质的量分别为x、y.则根据方程式中Cu与硝酸的物质的量关系可得x/2+3y/2=0.1;2x+4y=0.3.解得x=0.05;y=0.05.因此生成的气体中NO2的物质的量为0.05mol。(3)由方程式可以看出n(NOx)=n(NaOH).n(NOx)=n(NO2)+n(NO)= 0.05+0.05=0.1mol。所以n(NaOH)=0.1mol.V(NaOH)=n÷C=0.1mol÷1mol/L=0.1L=100ml。
本题难度:一般
4、选择题 向一洁净干燥的烧杯中加入44.4gAl粉与Fe粉混合物,然后加入过量的盐酸,产生标况下气体26.88L。若将该混合物加入500mL14 mol·L-1的HNO3中(不考虑发生钝化),产生的气体(标准状况下测定)如图所示,假设HNO3的还原产物为NO与NO2,那么理论上从哪一时刻开始产生NO气体?(假设浓度小于9mol/L为稀HNO3)
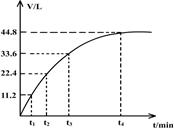
A.t1
B.t2
C.t3
D.t4
参考答案:C
本题解析:由Al粉与Fe粉的混合物共44.4g,与过量盐酸反应产生标况下?气体26.88L,根据得失电子守恒可以计算出Al与Fe分别是0.4mol、0.6mol,将该混合物加入500mL14 ?mol·L-1的HNO3中,若金属全部生成+3价硝酸盐,则未被还原的硝酸的物质的量为3mol,被还原的硝酸的物质的量由图中的气体体积可知是2mol,所以共消耗硝酸3+2=5mol<0.5ml×14 mol·L-1=7mol,硝酸过量,固体全部溶解。设气体产物中NO与NO2的物质的量分别为x、ymol,根据得失电子守恒可得,3x+y=(0.4+0.6)×3,x+y=2,解得x=0.5,y=1.5,1.5mol×22.4L/mol=33.6L,所以理论上在t3时刻开始产生NO气体,答案选C。
 考点:
考点:
本题难度:一般
5、选择题 常温下,在某200 mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。(设硝酸只被还原为NO气体, Fe的相对原子质量为56)。下列有关分析错误的是
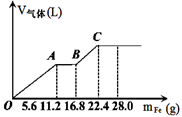
A.原混合酸中NO3-的物质的量为0.2 mol
B.原混合酸中H2SO4物质的量浓度为2mol/L
C.OA段与BC段反应中电子转移的物质的量之比为2:1
D.取20mL原混合酸加水稀释至1L后溶液的pH=1
参考答案:C
本题解析:硝酸是氧化性酸,因此首先与铁反应,即OA段表示铁与硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+4H++NO3-=Fe3++2H2O+NO↑。当NO3-完全被还原后继续介入铁粉,铁离子开始氧化铁粉,即AB段的离子方程式为Fe+2Fe3+=3Fe2+。最后加入铁粉氢离子与铁发生置换反应生成氢气,即BC段反应的离子方程式为Fe+2H+=F2+H2↑,据此可以判断。A、碘A时溶液中的NO3-尾气被还原为NO,此时消耗铁的质量是11.2g,物质的量=11.2g÷56g/mol=0.2mol,则根据方程式可知消耗NO3-的物质的量是0.2mol,所以原混合酸中NO3-的物质的量为0.2 mol,故A正确;B、最终消耗铁的质量是22.4g,物质的量=22.4g÷56g/mol=0.4mol。因此最终生成硫酸亚铁的物质的量是0.4mol。则根据原子守恒可知,硫酸的物质的量是0.4mol,则硫酸的浓度=0.4mol÷0.2L=2.0mol/L,B正确;C、OA段消耗0.2mol铁,转移0.2mol×3=0.6mol电子。BC阶段消耗铁的质量是22.4g-16.8g=5.6g,物质的量是0.1mol,则转移0.1mol×2=0.2mol电子。所以OA段与BC段反应中电子转移的物质的量之比为3:1,故C错误;D、原混合酸硝酸和硫酸的物质的量分别是0.2mol和0.4mol,其中氢离子的物质的量是0.2mol+0.4mol×2=1.0mol,则氢离子的浓度=1.0mol/L÷0.2L=5mol/L。所以取20mL原混合酸加水稀释至1L后溶液中氢离子的浓度=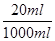 ×5mol/L=0.1mol/L,则溶液的pH=1,故D正确,答案选C。
×5mol/L=0.1mol/L,则溶液的pH=1,故D正确,答案选C。
本题难度:一般