1、填空题 高铁酸钾(K2FeO4)具有很强的氧化性,在生产、生活中有广泛应用。
(1)K2FeO4常用做高效水处理剂,其两种作用分别是_____。
[已知:FeO42-+3e-+4H2O Fe(OH)3+5OH-]
Fe(OH)3+5OH-]
(2)制备K2FeO4可以采用湿式氧化法,流程如下图:
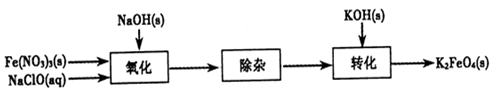
①完成氧化工序的离子方程式:
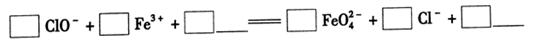
②除杂工序目的是除去Na2FeO4溶液中的杂质,除去的杂质主要有_____(写化学式)。
③转化工序控制在某温度下进行,则该温度下溶解度:Na2FeO4_____K2FeO4? (填“>”、“<”或“=”)。
(3)实验室模拟工业电解法制取K2FeO4,装置如右图。
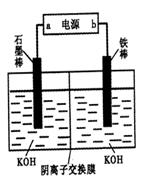
①此装置中电源的负极是____(填“a”或“b”)。
②阳极的电极反应式为______。
(4)已知K2FeO4稀溶液中存在如下平衡:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
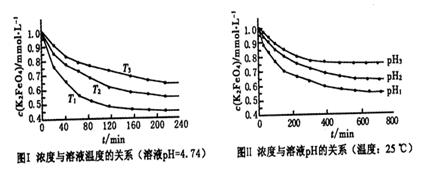
①由图I可得出的结论:该反应的△H___0(填“>”、“<”或“=”)。
②图Ⅱ中pH1___pH3(填“>”、“<”或“=”)。
参考答案:(1)杀菌和凝聚?(2)①ClO2-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O
②NaNO3、NaCl?③>?(3)①a?②Fe-6e-+8OH-=FeO42-+4H2O
(4)①>?②<
本题解析:(1)已知FeO42-+3e-+4H2O Fe(OH)3+5OH-,这说明K2FeO4具有强氧化性,能杀菌消毒。另外生成的铁离子水解生成氢氧化铁胶体具有吸附性,还起到净水剂的作用。
Fe(OH)3+5OH-,这说明K2FeO4具有强氧化性,能杀菌消毒。另外生成的铁离子水解生成氢氧化铁胶体具有吸附性,还起到净水剂的作用。
(2)①根据方程式可知,反应中氯元素的化合价从+1价降低到-1价,得到2个电子。铁的化合价从+3价升高到+6价,得到2个电子,因此根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是3:2。由于溶液显碱性,所以根据原子守恒可知,反应后还有水生成,则该反应的离子方程式为3ClO2-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O。
②根据原子守恒可知,反应中还有硝酸钠和氯化钠生成,所以除杂的目的是除去NaNO3、NaCl。
③根据该温度下高铁酸钠能转化为高铁酸钾,所以根据沉淀容易向更难的方向转化可知,高铁酸钠的溶解度大于高铁酸钾的溶解度。
(3)①电解法制取K2FeO4,则反应中铁应该是失去电子,所以铁是阳极,因此b是电源的正极,a是大于的负极。
②铁是阳极失去6个电子,因此阳极电极反应式为Fe-6e-+8OH-=FeO42-+4H2O。
(4)①由图I可知,温度T1首先达到平衡状态,这说明温度T1最高。但温度高K2FeO4溶液浓度越小,这说明升高温度平衡向正反应方向移动,因此正方应是吸热反应,即该反应的△H>0。
②pH越小,溶液的酸性越强,则溶液中OH-越小,有利于平衡向正反应方向移动。所以根据图2可知pH1时K2FeO4溶液浓度最小,因此pH1小于pH3。
本题难度:困难
2、填空题 (12分)我国有广阔的海岸线,海水综合利用大有可为。海水中溴含量为65 mg·L-1,从海水中提取溴的工业流程如下:
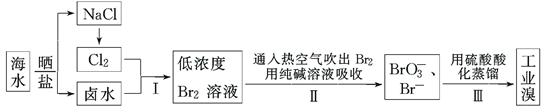
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:
________________________________________________________________________。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:

(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。
写出溴与二氧化硫水溶液反应的离子方程式:________________________________。
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是________。
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯
参考答案:(12分,每空2分)⑴富集溴元素
⑵C
⑶3 3 1 5 3
⑷SO2 +Br2+2H2O=4H+ +2Br -+SO42- 强酸对设备的严重腐蚀
⑸BD
本题解析:(1)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,目的是富集溴元素,尽可能提取海水中的溴;
(2)溴易挥发,所以用通入热空气或水蒸气的方法吹出Br2,答案选C。
(3)该反应中,反应物中的Br元素的化合价是0,生成物中的BrO的化合价是+5价,Br-的化合价是-1价,根据得失电子守恒的原则,BrO的系数是1,Br-的系数是5,所以Br2的系数是3,根据电荷守恒,CO的系数是3,CO2的系数是3;
( 4)溴与二氧化硫发生氧化还原反应生成溴化氢和硫酸,离子方程式为SO2 +Br2+2H2O=4H+ +2Br -+SO42- ;由于反应中生成了2种强酸,对设备的腐蚀性较强,所以除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀;
(5)可以用作溴的萃取剂应满足溴在该溶剂中的溶解度大于在水中的溶解度,且水与该溶剂是互不相溶的,A、乙醇与水互溶,错误;B、四氯化碳与水不互溶,且溴易溶于四氯化碳,符合萃取剂的选择,正确;C、裂化汽油中含有不饱和键,与溴发生加成反应,错误;D、苯与水不互溶且溴易溶于苯,正确,答案选BD。
考点:考查对工业流程的分析,物质的性质,方程式的配平,萃取剂的选择
本题难度:一般
3、简答题 人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用.粗盐中含有Ca2+、Mg2+、SO42-以及泥沙等杂质,请回答粗盐提纯的有关问题:
(1)为了除去粗盐中的泥沙,可采取的提纯实验操作方法的名称是______.
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤______.请补全实验步骤,并回答步骤③的目的是______.
(3)2010年7月26日,卫生部公布了《食用盐碘含量》的征求意见稿,面向社会征求意见.对于食用盐中碘含量平均水平的规定有所降低.食盐中添加的是KIO3.可用下列反应来检验食盐中是否含KIO3:KIO3+KI+H2SO4-I2+K2SO4+H2O?(未配平).请配平该反应并表示出电子转移的方向和数目______;为了获取反应后溶液中的I2,可采取的实验操作方法的名称是______.
参考答案:(1)可以先将粗盐和其中的泥沙溶解于水,氯化钠是易溶于水的,而泥沙是难溶于水的,而固体和液体的分离可以采用过滤方法,故答案为:溶解、过滤;
(2)在粗盐提纯时,要在最后一步加入盐酸,除去过量的氢氧根离子和碳酸根离子,加入碳酸钠的目的是除去钙离子和多余的钡离子,故答案为:加适量盐酸;?除去Ca2+及过量Ba2+;
(3)根据电子守恒和原子守恒来配平方程式,在氧化还原反应KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O中,化合价升高值=化合价降低值=转移电子数=6,电子转移情况如下:
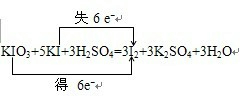
,碘单质从碘水中提取可以采用萃取分液法,利用四氯化碳来萃取,然后根据四氯化碳和碘的沸点的不同来分离,
故答案为:

;萃取、蒸馏.
本题解析:
本题难度:一般
4、选择题 在熔融KOH中,大气中的氧可将铬铁矿(FeCr2O4)中Fe和Cr的化合价都转化为+6价,氧化1 mol FeCr2O4在理论上需要氧气(?)
A.2 mol
B.2.5 mol
C.3 mol
D.4 mol
参考答案:B
本题解析:1 mol FeCr2O4中含Fe 1 mol,Cr 2 mol。在反应中,Fe的化合价由+2升到+6,Cr的化合价由+3升到+6,故两者共失去电子(6-2)×1 mol+(6-3)×2 mol="10" mol,根据得失电子守恒得n(O2)×4="10" mol,n(O2)=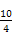 ?mol="2.5" mol。
?mol="2.5" mol。
本题难度:一般
5、选择题 元素X 的离子和其含氧酸根离子,在 pH=0的溶液中产生X 的单质沉淀,且氧化产物与还原产物质量之比为 2 : 1 . X 可能是
A.氯
B.硫
C.硅
D.铝
参考答案:B
本题解析:本题可直接判断, A、C12为气体,不可能形成沉淀, C、D 不可能发生氧化还原反应,只能选 B
本题难度:一般