1、填空题 高铁酸钾(K2FeO4)具有很强的氧化性,在生产、生活中有广泛应用。
(1)K2FeO4常用做高效水处理剂,其两种作用分别是_____。
[已知:FeO42-+3e-+4H2O Fe(OH)3+5OH-]
Fe(OH)3+5OH-]
(2)制备K2FeO4可以采用湿式氧化法,流程如下图:
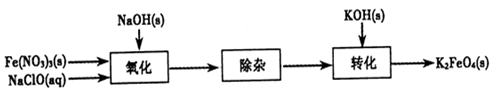
①完成氧化工序的离子方程式:
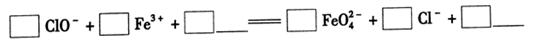
②除杂工序目的是除去Na2FeO4溶液中的杂质,除去的杂质主要有_____(写化学式)。
③转化工序控制在某温度下进行,则该温度下溶解度:Na2FeO4_____K2FeO4? (填“>”、“<”或“=”)。
(3)实验室模拟工业电解法制取K2FeO4,装置如右图。
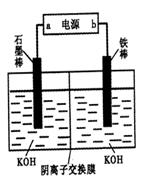
①此装置中电源的负极是____(填“a”或“b”)。
②阳极的电极反应式为______。
(4)已知K2FeO4稀溶液中存在如下平衡:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
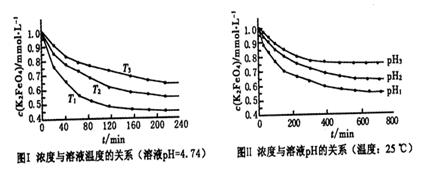
①由图I可得出的结论:该反应的△H___0(填“>”、“<”或“=”)。
②图Ⅱ中pH1___pH3(填“>”、“<”或“=”)。
2、填空题 (12分)我国有广阔的海岸线,海水综合利用大有可为。海水中溴含量为65 mg·L-1,从海水中提取溴的工业流程如下:
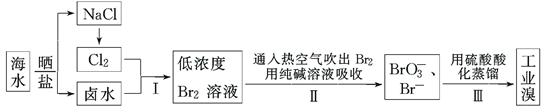
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:
________________________________________________________________________。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:

(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。
写出溴与二氧化硫水溶液反应的离子方程式:________________________________。
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是________。
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯
3、简答题 人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用.粗盐中含有Ca2+、Mg2+、SO42-以及泥沙等杂质,请回答粗盐提纯的有关问题:
(1)为了除去粗盐中的泥沙,可采取的提纯实验操作方法的名称是______.
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤______.请补全实验步骤,并回答步骤③的目的是______.
(3)2010年7月26日,卫生部公布了《食用盐碘含量》的征求意见稿,面向社会征求意见.对于食用盐中碘含量平均水平的规定有所降低.食盐中添加的是KIO3.可用下列反应来检验食盐中是否含KIO3:KIO3+KI+H2SO4-I2+K2SO4+H2O?(未配平).请配平该反应并表示出电子转移的方向和数目______;为了获取反应后溶液中的I2,可采取的实验操作方法的名称是______.
4、选择题 在熔融KOH中,大气中的氧可将铬铁矿(FeCr2O4)中Fe和Cr的化合价都转化为+6价,氧化1 mol FeCr2O4在理论上需要氧气(?)
A.2 mol
B.2.5 mol
C.3 mol
D.4 mol
5、选择题 元素X 的离子和其含氧酸根离子,在 pH=0的溶液中产生X 的单质沉淀,且氧化产物与还原产物质量之比为 2 : 1 . X 可能是
A.氯
B.硫
C.硅
D.铝