1、填空题 设空气中N2、O2的体积分数分别为0.8和0.2。在沸腾炉中将硫铁矿用空气充分煅烧:
4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
(1)所得气体中SO2的体积分数不超过________%(保留一位小数)。
(2)在实际生产中,接触室SO2与O2的体积比以1:4较为适合。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5 m3/ s,则再往接触室里通入的空气的流速应该为___________m3 / s(保留一位小数,气体体积在同温同压下测定)。
(3)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20: x,则x=_______,此时反应中SO2的转化率为__________%(保留一位小数)。
(4)硫酸厂常用氨水吸收尾气的SO2、SO3等,再向吸收液中加入浓硫酸,以制取高浓度的SO2和(NH4)2SO4、NH4HSO4固体。为了测定上述(NH4)2SO4、NH4HSO4固体混合物的组成,现称取该样品四份〔(NH4)2SO4和NH4HSO4的分解温度均高于200℃〕,实验数据如下:(气体均在标况下测定)
实验序号
| 样品的质量/g
| NaOH溶液的体积/mL
| 氨气的体积/L
|
1
| 3.62
| 50
| 0.896
|
2
| 7.24
| 50
| 1.792
|
3
| 10.86
| 50
| 2.016
|
4
| 14.48
| 50
| 1.568
|
①该混合物中(NH4)2SO4和NH4HSO4的物质的量之比____________
②所用NaOH溶液的物质的量浓度____________。
参考答案:(12分)
15.4%(2)6.8?(3) 8? 94.1%?(4)①1:2? ②3mol/L
本题解析:略
本题难度:一般
2、填空题 能证明SO2中混有CO2的方法是
A.通过品红溶液
B.通过澄清石灰水
C.先通过高锰酸钾溶液,再通过澄清石灰水
D.先通过澄清石灰水, 再通过高锰酸钾溶液
参考答案:C
本题解析:因SO2也能使澄清石灰水变浑浊,故先将混合气体通过高锰酸钾溶液,除去SO2(两者发生氧化还原反应),再通过澄清石灰水(与CO2反应,生成白色沉淀)来验证SO2中混有CO2;
本题难度:一般
3、选择题 二硫化碳(CS2)能够在氧气中燃烧生成CO2和SO2。今用0.228克CS2在448毫升氧气(标准状况)中完全燃烧,反应后气体混合物在标准状况时的体积是……( )
A.112毫升
B.224毫升
C.448毫升
D.201.6毫升
参考答案:C
本题解析:本题按常规解法是先算出CS2和O2的物质的量,然后考虑谁过量,再经过复杂的运算求出结果。若注意到CS2在标准状况下为液体,则可进行巧解。因为在标准状况下CS2为液体,所以反应前后气体的体积与CS2的质量无关。由反应CS2+3O2=CO2+2SO2可知,反应用去的O2体积与生成的CO2、SO2的体积之和相等。故反应前后气体体积不变,应选择C。
本题难度:一般
4、选择题 向某溶液中加入BaCl2溶液,再加入稀硝酸,产生的白色沉淀不消失,下列叙述正确的是(?)
A.溶液中一定含有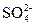
B.溶液中一定含有Ag+
C.溶液中一定含有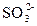
D.溶液中可能含有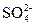 、
、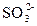 、Ag+中的某一种、两种或三种
、Ag+中的某一种、两种或三种
参考答案:D
本题解析:BaCl2溶液中的Cl-可与Ag+产生不溶于稀硝酸的白色沉淀AgCl;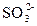 遇到稀HNO3会将其氧化成
遇到稀HNO3会将其氧化成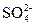 ,所以溶液中如果含有
,所以溶液中如果含有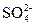 、
、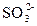 、Ag+中的某一种、两种或三种都会产生上述现象。
、Ag+中的某一种、两种或三种都会产生上述现象。
本题难度:简单
5、简答题 火电厂排放气体中含有二氧化硫、氮氧化物等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
(1)煤燃烧产生的烟气(含有氮氧化物、SO2、PM2.5等),直接排放到空气中,引发的主要环境问题有?(填写字母编号)
A水体富营养化? B重金属污染? C雾霾? D酸雨
(2)将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。写出亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式?。
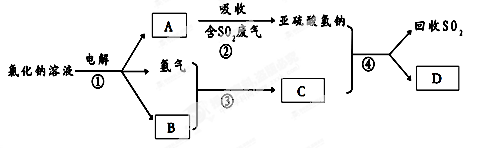
(3)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:
A的化学式?,若生成ag A,理论上可以回收SO2的质量为?g。
(4)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式?。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式?。
(5)工业上常用Na2CO3溶液处理煤燃烧产生的烟气,写出SO2、NO与Na2CO3溶液反应生成Na2SO4、N2的离子方程式?。
参考答案:(1)CD?
(2)Ca(HSO3)2+O2=CaSO4+H2SO4
(3)NaOH;1.6a
(4)3NO2+H2O==2HNO3+NO?2NO+2CO N2+2CO2
N2+2CO2
(5)2SO2 + 2NO +2CO32-=2SO42-+ N2 + CO2
本题解析:(1)氮氧化物和二氧化硫能引起酸雨,PM2.5直径小于等于2.5 微米的颗粒物,能长时间悬浮于空气中,能造成雾霾,故CD项正确。
(2)亚硫酸氢钙被足量氧气氧化生成硫酸钙,同时生成H2SO4,化学方程式为:Ca(HSO3)2+O2=CaSO4+H2SO4
(3)电解氯化钠溶液可得Cl2、H2、NaOH,A能吸收SO2,生成亚硫酸氢钠,则A为NaOH;SO2与NaOH反应的化学方程式为:SO2+NaOH=NaHSO3,NaOH的质量为ag,则理论上可以回收SO2的质量为:64/40×ag=1.6ag。
(4)NO2与水反应可生成HNO3,化学方程式为:3NO2+H2O=2HNO3+NO;当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,NOX与CO发生氧化还原反应,生成N2和CO2,所以NO被CO还原的化学方程式为:
2NO+2CO N2+2CO2
N2+2CO2
(5)SO2、NO与Na2CO3溶液反应生成Na2SO4、N2,发生了氧化还原反应,根据元素守恒可生成了CO2,所以离子方程式为:2SO2+ 2NO +2CO32-=2SO42-+ N2 + CO2
本题难度:一般