1、选择题 下列反应生成的新化合物中,不稳定的是?(?)
A.SO3与水
B.SO2与水
C.SO2与氯水
D.SO3与NaOH溶液
参考答案:B
本题解析:A稳定,生成物为硫酸;B不稳定,生成物为亚硫酸,具有不稳定性易分解;C稳定,生成物为硫酸;D稳定,生成物为硫酸钠;
本题难度:简单
2、选择题 有两支盛硝酸钡溶液的试管,向一支里加入盐酸,向另一支里加入烧碱溶液,再同时通入SO2,都有白色沉淀生成,由此可得出的结论是
A.两支试管里的沉淀都是亚硫酸钡
B.SO2在两个反应中分别表现出酸性、还原性
C.两支试管里的沉淀都是硫酸钡
D.亚硫酸钡在碱性溶液里是不溶解的
参考答案:D
本题解析:略
本题难度:简单
3、选择题 储存浓H2SO4的铁罐外口常会出现严重的腐蚀现象,这体现了(?)
A.浓H2SO4的吸水性和酸性
B.浓H2SO4的脱水性和吸水性
C.浓H2SO4的强氧化性和吸水性
D.浓H2SO4的吸水性和稀H2SO4的通性(酸性)
参考答案:D
本题解析:常温下铁在浓H2SO4中发生钝化,浓H2SO4吸水后变为稀H2SO4,而稀H2SO4具有酸的通性(酸性)。
本题难度:简单
4、选择题 2008年06月28日新华网消息:据美国《连线》杂志报道,一项研究表明,火星的液态水曾来自天空下的毛毛雨和地表收集的露水,这些降雨在火星土壤中留下了痕迹。硫酸盐似乎堆积在火星表面,下面是一层层的氯化物,这一模式表明水是从火星大气降落到火星土壤中的。这是因为(?)
A.硫酸盐不与水发生化学反应堆积在火星表面,而氯化物与水发生了化学反应进入了火星土壤内部。
B.硫酸盐在水中的溶解能力比不上氯化物,它们往往会最先被水分离出来,这意味着水在向下浸湿,将氯化物带到了硫酸盐之下的更深层的火星土壤中。
C.在火星上硫酸盐的密度与氯化物的小。
D.火星的大气中含有硫酸盐而不含有氯化物。
参考答案:B
本题解析:由于硫酸盐在水中的溶解能力比不上氯化物所以硫酸盐在火星表面,而氯化物在火星降雨过程中溶解在水中则进入更深层的火星土壤中。这一现象表明“火星的液态水曾来自天空下的毛毛雨和地表收集的露水”。
本题难度:一般
5、填空题 (本题共16分)防治环境污染是当前环保工作的重要研究内容之一。二氧化硫和氮氧化物是大气的主要污染物。
1.将1.5 mol SO2用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到_________________g石膏(CaSO4?2H2O)。
2.用CH4消除NOx污染的化学方程式为:
CH4+4NO → 2N2+CO2+2H2O;? CH4+2NO2 → N2+CO2+2H2O
现有11.2 L NO2、NO的混合气体NOx,将其还原为N2,需要4.48 L 的CH4,则混合气体中NO2、NO的物质的量分别为___________________。(体积都已换算为标准状况)
3.(1)常温下用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2可生成0.5 mol N2,则y=_______________。
(2)氧缺位铁酸锌ZnFe2Oz化学式的氧化物形式为aZnO?bFeO?cFe2O3。已知1 mol ZnFe2Oz最多能使4.0 L(标况)NO1.4转化为N2。则上述氧化物形式的化学式可具体表示为______________________________。
4.低温臭氧氧化脱硫脱硝技术可以同时吸收烟气中的氮氧化物和二氧化硫,反应原理是将NOx氧化成N2O5,通过洗涤形成硝酸盐,二氧化硫形成硫酸盐。其主要反应如下:
NO+O3 → NO2+O2 ……………………………………………①
2NO2+O3 → N2O5+O2 …………………………………………②
N2O5+2NH3+H2O → 2NH4NO3 ………………………………③
SO2+O3+2NH3+H2O → (NH4)2SO4+O2?……………………④
某热电厂烟气中平均含NOx 4.5‰、SO2 9.0‰(体积分数),压缩空气经臭氧发生器变成臭氧空气,其中O3浓度为90 L/m3,臭氧空气与加湿氨气和烟气混合反应。若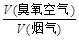 流量比为y,请通过计算列出y与x的关系式。
流量比为y,请通过计算列出y与x的关系式。
参考答案:(本题共16分)
1. 258(2分)
2. 0.3 mol 、0.2 mol(4分)。
3.(1)3(3分)。(2)4ZnO?2FeO?3Fe2O3(3分)。
4.(4分)由反应①②可知,O3在氧化过程中都生成O2,则NOx与O3反应时有如下关系:
2NOx + (5-2x)O3 + H2O → 2HNO3 + (5-2x)O2
设烟气为1m3,其中NOx为4.5L,SO2为9L,则有
2NOx ~ (5-2x)O3
2? 5-2x
4.5? 90y-9
解之y=0.225-0.05x
本题解析:1.由S的守恒: SO2? ~? CaSO4?2H2O
2.由题意得:2CH4 + 5NOx→5/2N2 + 2CO2 +4H2O ,由O原子守恒可知x=8/5
再由十字交叉法可知:NO为0.2mol 、NO2为0.3mol
3.(1)由题意及原子守恒可知:2 ZnFe2Oy+ 1 NO2→0.5 mol N2 + 2ZnFe2O4,
由氧原子守恒:2y+2=2×4,知y=3
(2)1 ZnFe2Oz+ 1/4 NO1.4→ 1/8 mol N2 + 1ZnFe2O4可求出,z=15/4
则 ZnFe2O15/4可写作 Zn4Fe8O15,可拆解为4ZnO?2FeO?3Fe2O3
本题难度:一般