1、选择题 北京市为了降低燃煤产生SO2的排放量,采取了许多有力的措施。措施之一是推广使用低硫煤,并向煤中加入石灰石,该方法可减少SO2的排放,此法称为“钙基固硫”。这种煤燃烧后,大部分硫元素最终存在形式为
A.CaSO4
B.CaSO3
C.CaS
D.SO3
参考答案:A
本题解析:钙基固硫过程中发生的反应:CaO+SO2=CaSO3,2CaSO3+O2=2CaSO4,所以硫元素主要以CaSO4形式存在。答案选A。2的性质
点评:本题比较基础,难度较小。
本题难度:简单
2、选择题 硫酸亚铁隔绝空气加强热分解形成四氧化三铁,将分解生成的气体通入氯化钡溶液中,下列叙述正确的是
A.产生BaSO4沉淀?
B.产生BaSO3沉淀?
C.产生BaSO4与BaSO3的混合沉淀
D.无沉淀产生
参考答案:A
本题解析:硫酸亚铁隔绝空气加强热分解形成四氧化三铁、二氧化硫、三氧化硫,二氧化硫不能与氯化钡溶液反应生成沉淀,三氧化硫与水反应生成硫酸其与氯化钡反应生成硫酸钡沉淀。
本题难度:一般
3、计算题 在标准状况下,将SO2和Cl2气体混合,测得混合气体相对HCl的密度是1.85。将该混合气体2.24L溶于100mL水中制成溶液,已知该溶液的密度为1.05? g/cm3。(已知:SO2+Cl2+2H2O=H2SO4+2HCl)计算该混合溶液中H+的物质的量浓度。(计算最终结果保留两位小数)
参考答案:1.97mol/L(6分)
本题解析:略
本题难度:一般
4、选择题 在某氯化钙溶液中通入二氧化硫气体,未见沉淀生成,若先加入另一种物质,再通入二氧化硫,则可以看到沉淀生成。此物质不可能是(?)
A?新制氯水? B?氨水?C?稀盐酸? D?双氧水
参考答案:C
本题解析:二氧化硫溶于水中生成亚硫酸,亚硫酸不能和氯化钙溶液反应,如果反应将生成CaSO3和盐酸,而弱酸亚硫酸不能制得强酸盐酸。AD中的新制氯水和双氧水均可将二氧化硫氧化为硫酸生成微溶物CaSO4。B中的氨水可使溶液先与二氧化硫反应生成亚硫酸铵再和氯化钙反应生成沉淀CaSO3。
本题难度:一般
5、实验题 下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略.
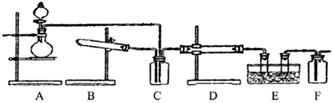
(一)甲同学认为当D处盛放V2O5作催化剂时,此套装置可用于合成物质X,并预测E处冰水冷却的U型管中将有固体X出现.
(1)事实上此装置所附实验说明符合甲同学的推断,那么A中所发生的反应的化学反应方程式是:__________,C装置中盛放的液体药品的名称是______________。
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量,欲知A、B两装置中产物在D中的通入量,可通过观察__________得知.
(3)本实验在设计上_________(填有、无)缺失之处?若有请给出改进方案。(若无,此问可不答)
(二)乙同学认为若D处盛放铂铑合金网作催化剂,则此套装置也可用于合成物质Y,并预测E处冰水冷却的U型管中将有红棕色气体生成,且越接近U型管底部颜色越浅.
(4)写出乙同学认为的D装置中发生反应的化学方程式_________________________________。
(5)对于A处,乙认为不需加热装置。则A处仪器中分别放置的药品为:分液漏斗中____________圆底烧瓶中_________
(6)若要用上述装置完成乙同学所认为的实验,且C处所起作用与合成X时所起作用基本一致,那么C处的广口瓶应改为__________所装药品为_____________。
参考答案:
(1)Na2SO3+H2SO4?Na2SO4+H2O+SO2↑; 浓硫酸?
(2)C中两导管口气泡的逸出速率
(3)有; 应在E与F之间连接一个防倒吸装置
(4)4NH3+5O2 4NO+6H2O(2NO+O2?2NO2不写也可以)
4NO+6H2O(2NO+O2?2NO2不写也可以)
(5)浓氨水; 固体NaOH(或生石灰或碱石灰)
(6)U形管或干燥管; 碱石灰
本题解析:
(1)V2O5是SO2氧化为SO3的催化剂。所以该装置是用于合成SO3的装置。A是制取SO2的装置,在A中所发生的反应的化学反应方程式Na2SO3+H2SO4=Na2SO4+H2O+SO2↑; B是制取O2的装置,反应原理为2KClO3 2KCl+3O2↑。在装置C中装有浓硫酸,其作用是一是干燥气体;二是通过观察气泡来混合气体。
2KCl+3O2↑。在装置C中装有浓硫酸,其作用是一是干燥气体;二是通过观察气泡来混合气体。
(2)反应2SO2+ O2 2SO3是可逆反应,为了提高SO2的转化率,可以通过增大O2的浓度的方法来实现。欲知A、B两装置中产物在D中的通入量,可通过观察C装置中两导管口气泡的逸出速率得知.
2SO3是可逆反应,为了提高SO2的转化率,可以通过增大O2的浓度的方法来实现。欲知A、B两装置中产物在D中的通入量,可通过观察C装置中两导管口气泡的逸出速率得知.
(3)本实验在设计上有缺陷。由于E降温导致整个装置中的气体压强减小,这样F中的液体容易倒吸至装置E中,导致实验失败。改进的措施是在E与F之间连接一个防倒吸装置。
(4)铂铑合金网作催化剂是氨气催化氧化的催化剂。A装置用于制取氨气,反应的方程式为:Ca(OH)2+2NH4Cl 2NH3↑+2H2O+CaCl2,B装置用于制取O2,反应的方程式为:2KClO3
2NH3↑+2H2O+CaCl2,B装置用于制取O2,反应的方程式为:2KClO3  ?2KCl+3O2↑。在C装置中干燥并混合气体,在D中发生反应:4NH3+5O2
?2KCl+3O2↑。在C装置中干燥并混合气体,在D中发生反应:4NH3+5O2 4NO+6H2O。在E中发生反应2NO+O2=2NO2得到红棕色的NO2。
4NO+6H2O。在E中发生反应2NO+O2=2NO2得到红棕色的NO2。
(5)对于A处,若不需加热装置。则A处仪器中分别放置的药品为:分液漏斗中装浓氨水,圆底烧瓶中CaO、Ca(OH)2、NaOH、碱石灰等有吸水性的物质。这些物质吸水放热,可以使一水合氨分解产生氨气。
(6)由于氨气是碱性气体,所以若要用上述装置完成乙同学所认为的实验,且C处所起作用与合成X时所起作用基本一致,那么C处的广口瓶应改为U形管或干燥管; 所装药品为碱性干燥剂如碱石灰3、NO的原料气的制取、混合、干燥、合成、注意事项等实验操作和反应原理等知识。
本题难度:一般