| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《化学平衡》考点预测(2019年强化版)(十)
参考答案:A 本题解析:根据化学方程式可知,该反应是体积增大的、吸热的可逆反应,所以升高温度或降低压强,反应都是向正反应方向进行的,COCl2转化率增大;恒容通入惰性气体,浓度不变,平衡不移动,转化率不变。增大CO的浓度,平衡向逆反应方向移动,转化率降低。催化剂不能改变平衡状态,转化率不变。恒压通入惰性气体,则容积增大,相当于减压平衡向正反应方向移动,COCl2转化率增大;选A。 本题难度:一般 2、选择题 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g) |
参考答案:B
本题解析:A、若纵坐标表示C的产率,随温度升高,平衡正向移动,则C的产率增大,符合图像,正确;B、纵坐标不一定表示混合气体的平均摩尔质量,当x>3时,升高温度,平衡正向移动,而混合气体的平均摩尔质量减小,与图像不符,错误;C、若p1>p2,纵坐标表示C的产率,说明增大压强,C的产率增大,平衡正向移动,则x=1或2,正确;D、若p1<p2,纵坐标表示C的产率,说明减小压强,C的产率增大,则正反应是气体物质的量增大的方向,此时x>3,所以x的取值与p1、p2的相对大小有关,正确,答案选B。
考点:考查对平衡图像的分析,平衡移动的判断
本题难度:一般
3、选择题 在一密闭容器中,反应mA(g)+nB(g)?pC(g),达到平衡时,测得c(A)为0.5mol/L;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3mol/L.则下列判断正确的是( )
A.化学计量数:m+n>p
B.平衡向正反应方向移动
C.物质B的转化率增大
D.物质C的质量分数增加
参考答案:在温度不变的情况下,将容积增大一倍,如平衡不移动,则c(A)应为0.25mol/L,而达到平衡时c(A)=0.30mol/L,说明平衡向逆反应方向移动,则有m+n>3,
A.由分析可知,m+n>3,故A正确;
B.由分析可知,平衡向逆反应方向移动,故B错误;
C.平衡向逆反应方向移动,B的转化率降低,故C错误;
D.平衡向逆反应方向移动,物质C的质量分数减小,故D错误.
故选A.
本题解析:
本题难度:简单
4、填空题 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)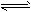 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___________。
(2)该反应为___________反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是___________。
(a)容器中压强不变
(b)混合气体中 c(CO)不变
(c)v正(H2)=v逆(H2O)
(d)c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
___________ ℃。
参考答案:(1)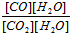
(2)吸热
(3)bc
(4)830
本题解析:
本题难度:一般
5、填空题 氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为 。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题: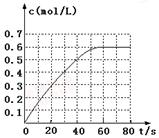
① 298k时,该反应的平衡常数为 L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序 。
③d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
参考答案:(14分)
(1)C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ/mol
(2)①6.67 ②A ③<
(3)①NH4+ ②c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) ③>
本题解析:(1)偏二甲肼(C2H8N2)和液态N2O4反应,生成无毒、无污染的气体氮气和水,已知1 g燃料完全燃烧释放出的能量为42.5 kJ,则1 mol燃料完全燃烧释放出的能量为2550 kJ,所以该反应的热化学方程式为C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ/mol 。
(2)①由图像可知看出c(N2O4 )="0.6" mol/L,N2O4的浓度为NO2的2倍,则c(NO2 )=0.3,298k时,该反应的平衡常数为0.6÷0.32 = 6.67。
②A.在恒容密闭容器中,混合气体的密度始终保持不变,不能说明反应处于平衡状态;B.NO2是红棕色气体,当反应向右进行时,混合气体的颜色变浅,当混合气体的颜色不再变化时,反应处于平衡状态;C.该反应是气体体积减小的可逆反应,压强随着反应的进行而减小,当气压恒定时,反应处于平衡状态,选A。
③在398K,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,该容器的体积为2 L,Q=0.6÷0.32=6.67,等于298K时的平衡常数,而该反应是放热反应,升高温度,K值减小,所以Q>K (398K),平衡逆向移动,则此时V(正)<V(逆)。
(3)①在b点,等浓度、等体积的NH4HSO4与NaOH溶液1:1恰好反应生成硫酸铵,溶液中发生水解反应的离子是NH4+ ;
②在c点,溶液呈中性,c(OH-)=c(H+)但最小,在b点溶液中含有等物质的量的Na+、NH4+ 、SO42-,该溶液因NH4+ 的水解而显酸性,要想使溶液呈中性,需再加NaOH到c点,所以溶液中各离子浓度由大到小的排列顺序为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
③d点是硫酸铵和氨水的混合溶液,氨水的浓度较大,对水的电离抑制程度较弱,e点是硫酸钠与氨水的混合溶液,氨水的浓度较大,对水的电离抑制程度较大,所以d、e点对应溶液中,水电离程度大小关系是d>e。
考点:考查热化学方程式的书写,化学平衡常数的计算,化学平衡状态的判断以及有关电解质溶液的图像。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《铁》考点预.. | |