1、填空题 铁及其化合物在生产、生活中应用广泛.
(1)一定条件下,Fe与CO2可发生反应:2Fe(s)+3CO2(g)?Fe2O3(s)+3CO(g)该反应的平衡常数(K)随温度(T)升高而增大.
①该反应的平衡常数K=______.(填表达式)②下列措施中,能使平衡时
增大的是______(填标号).
A.升高温度?B.增大压强? C.充入一定量CO?D.再加一些铁粉
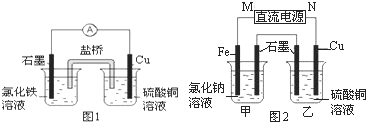
(2)图1装置发生反应的离子方程式为______.
(3)图2装置中甲烧杯盛放100mL?0.2mol/L的NaCl溶液,乙烧杯盛放100mL?0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红.
①电源的M端为______极,甲烧杯中铁电极的电极反应为______.
②乙烧杯中电解反应的化学方程式为______.
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重?0.64g,甲烧杯中产生的气体标准状况下体积为______mL.
2、简答题 合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol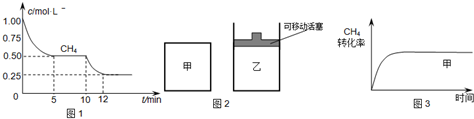
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应中处于平衡状态的时间为______;10min时,改变的外界条件可能是______.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)反应CO(g)+H2O(g)?CO2(g)+H2(g)800℃时,反应的化学平衡常数K=1.0.
①某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2
0.5mol
8.5mol
2.0mol
2.0mol
|
此时反应中正、逆反应速率的关系式是______(填代号).
a.v(正)>v(逆)b.v(正)<v(逆)c.v(正)=v(逆)d.无法判断
②800℃时,向体积为2L的密闭容器中充入2molCO和4molH2O,求达到平衡时CO的转化率.
3、选择题 已知:CO2(g) + 3H2(g) 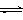 ?CH3OH(g) + H2O(g)? ΔH=-49.0 kJ?mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
?CH3OH(g) + H2O(g)? ΔH=-49.0 kJ?mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是

A.10min后,升高温度能使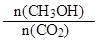 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol·L-1?min-1
4、选择题 下列事实不能用勒夏特利原理来解释的是:
A.升高温度,水的电离平衡向正方向移动
B.合成氨工业选择高温
C.增大压强,有利于SO2和O2反应生成SO3
D.在Fe3++3KSCN Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深