1、填空题 铁及其化合物在生产、生活中应用广泛.
(1)一定条件下,Fe与CO2可发生反应:2Fe(s)+3CO2(g)?Fe2O3(s)+3CO(g)该反应的平衡常数(K)随温度(T)升高而增大.
①该反应的平衡常数K=______.(填表达式)②下列措施中,能使平衡时
增大的是______(填标号).
A.升高温度?B.增大压强? C.充入一定量CO?D.再加一些铁粉
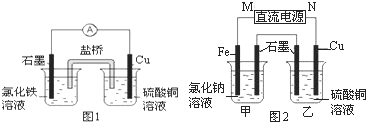
(2)图1装置发生反应的离子方程式为______.
(3)图2装置中甲烧杯盛放100mL?0.2mol/L的NaCl溶液,乙烧杯盛放100mL?0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红.
①电源的M端为______极,甲烧杯中铁电极的电极反应为______.
②乙烧杯中电解反应的化学方程式为______.
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重?0.64g,甲烧杯中产生的气体标准状况下体积为______mL.
参考答案:(1)①2Fe(s)+3CO2(g)?Fe2O3(s)+3CO(g)平衡常数表达式k=c3(CO)c3(CO2),故答案为:c3(CO)c3(CO2);
②2Fe(s)+3CO2(g)?Fe2O3(s)+3CO(g)该反应的平衡常数(K)随温度(T)升高而增大,23Fe(s)+CO2(g)?13Fe2O3(s)+CO(g)的平衡常数表达式k=c(CO)c(CO2),应升高温度使之增大,故答案为:A;
(2)装置1为原电池,负极为Cu,电极反应为:Cu-2e-═Cu2+,正极为石墨,电极反应为2Fe+2e-═2Fe2+,反应的总方程式为2Fe3++Cu═2Fe2++Cu2+,
故答案为:2Fe3++Cu═2Fe2++Cu2+;
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,
发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,N端为负极,阳极反应为Fe-2e-═Fe2+,故答案为:正;Fe-2e-═Fe2+;
②乙烧杯电解硫酸铜溶液,石墨为阳极,电极反应为4OH--4e-═O2↑+H2O,Cu为阴极,电极反应为Cu2++2e-═Cu,电解的总反应为2CuSO4+2H2O?通电?.?2Cu+O2↑+2H2SO4,
故答案为:2CuSO4+2H2O?通电?.?2Cu+O2↑+2H2SO4;
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为0.64g64g/mol=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
根据甲烧杯产生气体的电极反应计算生成气体的体积,
?2H2O+2e-═2OH-+H2↑,
? 2mol? 22.4L
?0.02mol? ?V
V=22.4L×0.02mol2mol=0.224L,即224ml,
故答案为:224.
本题解析:
本题难度:一般
2、简答题 合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol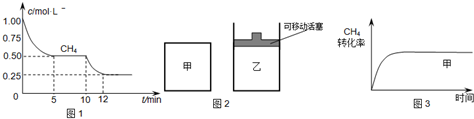
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应中处于平衡状态的时间为______;10min时,改变的外界条件可能是______.
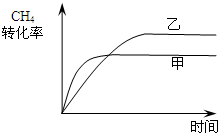
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)反应CO(g)+H2O(g)?CO2(g)+H2(g)800℃时,反应的化学平衡常数K=1.0.
①某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2
0.5mol
8.5mol
2.0mol
2.0mol
|
此时反应中正、逆反应速率的关系式是______(填代号).
a.v(正)>v(逆)b.v(正)<v(逆)c.v(正)=v(逆)d.无法判断
②800℃时,向体积为2L的密闭容器中充入2molCO和4molH2O,求达到平衡时CO的转化率.
参考答案:(1)由图可知,由图可知,在5~10分钟、12分钟后,甲烷浓度不变,是平衡状态;10min时甲烷的浓度继续减小,该反应向正反应方向移动,而该反应为吸热反应,则升高温度符合题意,
故答案为:5~10分钟、12分钟后;升高温度;
(2)甲、乙两容器中分别充入等物质的量的CH4和CO2,且甲、乙两容器初始容积相等,由图可知,甲的体积不变,乙的压强不变,则假定甲不变,乙中发生CH4+CO2?2CO+2H2,其体积增大,则相当于压强减小,化学平衡向正反应方向移动,乙容器中CH4的转化率增大,但压强小,反应速率减慢,则达到平衡的时间变长,则乙中CH4的转化率随时间变化的图象为:
 ,
,
故答案为: ;
;
(3)由表格中的数据可知,气体的体积相同,则物质的量与浓度成正比,Qc=2.0×2.02.0×8.5<K=1.0,该反应向正反应方向移动,则正反应速率大于逆反应速率,即选a,
故答案为:a;
②800℃时,反应的化学平衡常数K=1.0,向体积为2L的密闭容器中充入2mol CO和4mol H2O,设参加反应的CO为xmol;
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):2 4 0 0
转化量(mol):x x x x
平衡量(mol):2-x 4-x xx
K=c(CO2)c(H2)c(CO)c(H2O)=x2?x22-x2?4-x2=1,
所以x=43mol,
所以平衡时CO的转化率为:43mol2mol×100%=66.7%,
答:达到平衡时CO的转化率66.7%.
本题解析:
本题难度:简单
3、选择题 已知:CO2(g) + 3H2(g)  ?CH3OH(g) + H2O(g)? ΔH=-49.0 kJ?mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
?CH3OH(g) + H2O(g)? ΔH=-49.0 kJ?mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是

A.10min后,升高温度能使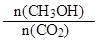 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol·L-1?min-1
参考答案:B
本题解析:A、该反应为放热反应,升高温度使平衡向左移动,所以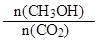 减小,错误;B、CO2的转化浓度为1.00mol?L?1-0.25mol?L?1=0.75mol?L?1,所以转化率为0.75mol?L?1÷1.00mol/L×100%=75%,正确;C、3 min时,反应还未达到平衡,所以用CO2的浓度表示的正反应速率不等于用CH3OH的浓度表示的逆反应速率,错误;D、υ(H2)=3υ(CO2)=3×0.75mol?L?1÷10min=0.225mol·L-1?min-1,错误。
减小,错误;B、CO2的转化浓度为1.00mol?L?1-0.25mol?L?1=0.75mol?L?1,所以转化率为0.75mol?L?1÷1.00mol/L×100%=75%,正确;C、3 min时,反应还未达到平衡,所以用CO2的浓度表示的正反应速率不等于用CH3OH的浓度表示的逆反应速率,错误;D、υ(H2)=3υ(CO2)=3×0.75mol?L?1÷10min=0.225mol·L-1?min-1,错误。
本题难度:一般
4、选择题 下列事实不能用勒夏特利原理来解释的是:
A.升高温度,水的电离平衡向正方向移动
B.合成氨工业选择高温
C.增大压强,有利于SO2和O2反应生成SO3
D.在Fe3++3KSCN Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深