1、填空题 (12分)已知A、B、C、D、E都是周期表中前 四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B
四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B 、C是同一周期的非金属元素。化合物DC形成的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为29。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所
、C是同一周期的非金属元素。化合物DC形成的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为29。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所 对应的元素符号表示)
对应的元素符号表示)
(1)AC2在H2C(C的氢化物)中的溶解度不大,其主要原因是?。
(2)B的氢化物的分子空间构型是?,其中心原子采取?杂化。
(3)写出化合物AC2的电子式?;一种由B、C组成的化合物与AC2互为等电子体,其化学式为?。
(4)向ESO4中逐滴加氨水至氨水过量,其现象为?;产生此现象的原因(用离子方程式表示)?;?。
参考答案:(1)CO2是非极性分子,H2O是极性分 子,根据相似相容原理,CO2在H2O中的溶解度不大(2分)
子,根据相似相容原理,CO2在H2O中的溶解度不大(2分)
(2)三角锥形? sp3 (各1分)(3)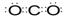 ? N2O(各1分)
? N2O(各1分)
(4)先出现蓝色絮状沉淀,沉淀溶解成深蓝色溶液(2分)
Cu2+ + 2NH3·H2O=Cu(OH)2↓ +2NH4+(2分)Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-(2分)
本题解析:略
本题难度:一般
2、选择题 请依据原子核外电子填充规律,分析氢原子的3d和4s能级的能量高低是
A.无3d、4s轨道,无所谓能量高低
B.3d>4s
C.3d=4s
D.3d<4s
参考答案:D
本题解析:氢原子只是填充了1s层的一个电子,不存在电子间能级交错,各轨道的能量只取决于主量子数n,即n越大,能量越高,所以3d<4s。
本题难度:一般
3、选择题 下列叙述中正确的是(? )
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指IA族的所有元素
参考答案:C
本题解析:F没有最高正价,故A错误;第六周期为32种元素,故B错误;碱金属元素是指IA族的除了H以外的金属元素,故D错误。
本题难度:简单
4、选择题 A和B两元素分别得到两个电子后,都变成零族元素的电子层结构,其中A放出的能量比B大,因此
A.A比B容易被还原
B.A2-的还原性比B2-的强
C.A的氧化性比B弱
D.A2-比B2-的半径大
参考答案:A
本题解析:略
本题难度:简单
5、选择题 下列微粒中半径最小的是(?)
A.Na
B.Na+
C.Mg2+
D.K
参考答案:C
本题解析:微粒半径主要由电子层数及核电荷数来决定
本题难度:一般