|
高考化学知识点归纳《弱电解质电离平衡》高频考点强化练习(2019年最新版)(十)
2019-07-04 01:56:53
【 大 中 小】
|
1、选择题 下列溶液中各微粒的浓度关系不正确的是
A.0.1mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.0.1mol·L-1 NH4Cl溶液中:c(NH4+)+c(NH3?H2O)=c(Cl-)
C.0.1mol·L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的CH3COONa和弱酸CH3COOH混合后的溶液中:c(CH3COO-)
|
参考答案:
本题解析:
本题难度:一般
2、选择题 pH=1的两种一元酸HX和HY溶液,分别取100mL加入足量的镁粉,充分反应后,收集到H2体积分别为VHX和VHY。若相同条件下VHX>VHY,则下列说法正确的 (?)?
A.HX可能是强酸
B.HY一定是强酸
C.HX的酸性强于HY的酸性
D.反应开始时二者生成H2的速率相等
参考答案:B
本题解析:pH=1的两种一元酸HX和HY溶液,分别取100mL加入足量的镁粉,充分反应后,收集到H2体积分别为VHX和VHY。若相同条件下VHX>VHY,说明HX一定是弱酸,故选B。
点评:等浓度等体积的酸,和足量的锌反应,生成的氢气一样多;等PH的两种一元酸HX和HY溶液,和足量的锌反应,生成氢气多的是弱酸,因为,弱酸分子还会电离出一部分氢离子,最后也会转化成为氢气。
本题难度:一般
3、简答题 Ⅰ.已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
| ① | HF | Ka=6.8×10-4mol?L-1
②
CH3COOH
Ka=1.7×10-5mol?L-1
③
HCN
Ka=6.2×10-10mol?L-1
④
H2CO3
Ka1=4.4×10-7mol?L-1
Ka2=4.7×10-11mol?L-1
|
根据上述数据,回答下列问题:
(1)四种酸中酸性最强的是______,四种酸中酸性最弱的是______.
(2)写出H2CO3电离方程式是______、______.
(3)写出下列反应的化学方程式:足量的氢氟酸与碳酸钠溶液混合:______;足量的CO2通入NaCN溶液中:______.
Ⅱ.氨水中存在:NH3?H2O?NH4++OH-,在5份0.01mol?L-1的氨水中分别加入下列各物质:
A.浓氨水B.纯水C.少量NaOH固体D.少量浓硫酸 E.NH4Cl固体
按照要求填空:
(1)电离平衡会向正向移动是______;电离平衡会向逆向移动是______.
(2)c(NH4+)、c(OH-)都增大的是______;c(NH4+)、c(OH-)都较小的是______.
(3)c(NH4+)增大,c(OH-)减小的是______;c(NH4+)减小,c(OH-)增大的是______.
参考答案:Ⅰ.(1)四种酸中HF的电离平衡常数最大,则HF酸最强,HCN的电离平衡常数最小,则HCN酸性最弱,
故答案为:HF;HCN;
(2)碳酸为二元弱酸,分步电离,以第一步电离为主,电离方程式为H2CO3?HCO3-+H+、HCO3-?CO32-+H+,
故答案为:H2CO3?HCO3-+H+;HCO3-?CO32-+H+;
(3)酸性强弱HF>H2CO3>HCN>HCO3-,可发生反应生成NaF和CO2,反应的方程式为2HF+Na2CO3═2NaF+H2O+CO2↑,足量的CO2通入NaCN溶液中,发生的反应方程式为NaCN+H2O+CO2═HCN+NaHCO3,
故答案为:2HF+Na2CO3═2NaF+H2O+CO2↑;NaCN+H2O+CO2═HCN+NaHCO3;
Ⅱ.(1)加水稀释促进一水合氨电离,加入浓氨水,一水合氨浓度增大平衡正向移动,加入浓硫酸,和氢氧根离子反应促进一水合氨电离,所以促进一水合氨电离的是ABD;
加入少量氢氧化钠,c(OH-)增大抑制一水合氨电离,加入少量氯化铵,c(NH4+)增大,抑制一水合氨电离,所以抑制一水合氨电离的是CE;
故答案为:ABD;CE;
(2)向溶液中加入浓氨水,促进一水合氨电离,溶液中c(NH4+)、c(OH-)都增大;
向溶液中加入水,促进一水合氨电离,但铵根离子或氢氧根离子增大的倍数小于溶液体积增大的倍数,所以c(NH4+)、c(OH-)都减小;
故答案为:A;B;
(3)向溶液中加入氯化铵,铵根离子浓度增大抑制一水合氨电离,则氢氧根离子浓度减小;向溶液中加入氢氧化钠固体,溶液中氢氧根离子浓度增大抑制一水合氨电离,则铵根离子浓度减小,
故答案为:E;C.
本题解析:
本题难度:简单
4、选择题 给试管中某红色溶液加热,溶液颜色逐渐变浅,则原溶液可能是
①滴有石蕊的NH4Cl溶液?②滴有酚酞的氨水溶液?③滴有石蕊的H2SO4溶液?④滴有酚酞的饱和氢氧化钙溶液?⑤滴有酚酞的Na2CO3溶液?⑥溶有SO2的品红溶液
A.②④
B.①③⑤
C.①④⑥
D.②③
参考答案:A
本题解析:① NH4Cl是强酸弱碱盐,在溶液中NH4+水解是溶液呈酸性,所以滴加石蕊试液溶液变为红色。由于盐水解反应是吸热反应,所以升高温度,NH4Cl水解程度增大,溶液的酸性增强,溶液红色逐渐加深。错误。②氨水显碱性,滴加酚酞溶液变为红色。给试管加热,由于氨水不稳定,受热容易分解,氨气逸出,溶液的碱性减弱,所以红色变浅。正确。③H2SO4溶液是酸性的,能使紫色石蕊试液变为红色。由于它是强电解质,稳定性强。加热时既不分解,也不再电离,所以溶液的红色不变。错误。④氢氧化钙是强碱,能使无色的酚酞变为红色,但其溶解度随温度的升高而降低,所以给试管中的时饱和氢氧化钙溶液加热时由于溶解度的减小c(OH-)降低,溶液的碱性减弱,所以红色变浅。正确。⑤Na2CO3是强碱弱酸盐水解使溶液显碱性所以滴加酚酞试液变为红色。由于升高温度促进盐的水解,所以加热试管时红色变深。错误。⑥品红溶液是红色的,当其中溶有SO2的时候,由于SO2有漂白性,所以溶液呈无色。该无色物质不稳定,受热容易分解。所以给试管中的物质加热时溶液又变为红色。错误。
本题难度:一般
5、填空题 已知HA是一种弱酸。请回答下列问题:
(1)现有一种含有HA和其钠盐NaA的溶液。
①组成该溶液的微观粒子有?;
②若向该溶液中加入少量盐酸时,发生反应的离子方程式是?;
③若向该溶液中逐滴加入NaOH溶液时,下列图像能表示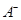 离子数目变化趋势的是?(填字母)。 离子数目变化趋势的是?(填字母)。
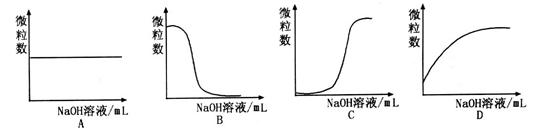
(2)现将1体积0.04mol 溶液和1体积0.02mol 溶液和1体积0.02mol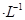 NaOH溶液混合,得到2体积混合溶液。 NaOH溶液混合,得到2体积混合溶液。
①若该混合液显碱性,则其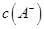 ?0.01 mol ?0.01 mol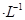 (填“<”、“=”或“>”); (填“<”、“=”或“>”);
②若该混合液显酸性,则溶液中所有离子的浓度由大到小的顺序是?。
参考答案:(1)①H2O、HA、H+、Na+、OH?、A-(2分,有错不得分)
②A-+H+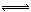 HA(2分,不写可逆号也可) HA(2分,不写可逆号也可)
③D(1分)
(2)①<(1分)
②c(A-)>c(Na+)>c(H+)>c(OH?)(2分)
本题解析:(1)①溶液中的微观粒子既包括离子,也包括分子,所以含有HA和其钠盐NaA的溶液的微观粒子有:H2O、HA、H+、Na+、OH?、A-
②加入少量盐酸,HCl与NaA反应生成HA,所以离子方程式为:A-+H+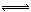 HA HA
③溶液含有HA和NaA,逐滴加入NaOH溶液,HA与NaOH反应生成NaA和H2O,所以A2-数目逐渐增大,故D项正确。
(2)①1体积0.04mol/LHA溶液和1体积0.02mol/LNaOH溶液混合,HA过量,得到等量的NaA和HA,若该混合液显碱性,则c(H+)<c(OH?),根据电荷守恒c(H+)+c(Na+)=c(OH?)+c(A-)可得c(A-)<0.01mol?L?1。
②若该混合液显酸性,则HA的电离程度大于NaA的水解程度,溶液中所有离子的浓度由大到小的顺序是:c(A-)>c(Na+)>c(H+)>c(OH?)
本题难度:一般
|