|
高中化学知识点总结《物质的量》试题巩固(2019年最新版)(四)
2019-07-04 01:57:55
【 大 中 小】
|
1、计算题 
参考答案:
本题解析:略
本题难度:一般
2、选择题 下列说法中不正确的是
A.物质的量是一个物理量,物质的量的单位是摩尔
B.2 mol水的摩尔质量是1 mol水的摩尔质量的2倍
C.摩尔质量、气体摩尔体积、物质的量的浓度的单位分别是g/mol、L/mol、mol / L
D.标准状况下,2L二氧化碳和3L一氧化碳所含有的原子数目相等.
|
参考答案:B
本题解析:2 mol水的摩尔质量是1 mol水的摩尔质量的2倍,说法错误,物质的摩尔质量是指的单位物质的量的物质所具有的质量,故B说法错误。
考点:化学计量
点评:考查化学量的计算,难度不大,解题的技术是要牢记摩尔质量的定义。
本题难度:简单
3、选择题 I.下面是几种实验中常用的仪器:
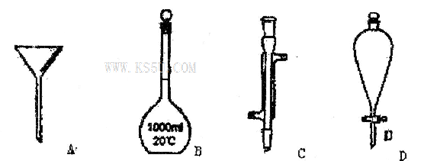
写出序号所代表的仪器的名称:
A____________;B____________;C_____________;D______________.
Ⅱ.实验室要配制480 mL, O.2 mol/L NaOH溶液,请回答下列问题:
(1)配制过程中不需要使用的化学仪器有___________(填选项的字母)。
A.烧杯 B.500 mL容量瓶 C.漏斗 D.胶头滴管? E.玻璃棒
(2)用托盘天平称取氢氧化钠,其质量为_______________g。
(3)取用任意体积的该NaOH溶液时,下列物理量中不随所取体积的多少而变化的是________________________。
A.溶液中NaOH的物质的量 ?B.溶液的浓度
C.溶液中的数目?D.溶液的密度
(4)在配制上述溶液的过程中,下列情况对NaOH溶液物质的量浓度有何影响(填”偏高”、”偏低”、或”无影响”)
①未经冷却趁热将溶液注入容量瓶中:__________________。
②容量瓶用蒸馏洗涤后残留有少量的水:_______________。
③定容时某同学观察液面的情况如图所示,则所配置的溶液的浓_______________。
④转移溶液后,未洗涤烧杯和玻璃棒就直接定容______________。
参考答案:Ⅰ、A:漏斗 B、1000mL容量瓶 C、冷凝管 D、分液漏斗
Ⅱ、(1)C
(2)4.0(写成4扣1分)
(3)B、D
(4)①偏高;②无影响;③偏高;④偏低。
本题解析:Ⅰ、实验室中常见面仪器:A:漏斗 B、1000mL容量瓶 C、冷凝管 D、分液漏斗
Ⅱ、(1)实验室中配制一定物质的量浓度的溶液时,不需要用到漏斗。
(2)因为实验室中没有480 mL 的容量瓶,所以选用500 mL 的容量瓶,那么在计算氢氧化钠的用量时,就要用500 mL 来进行,因此为0.5L×0.2 mol/L=0.1mol,换算成质量为4g,但由于是用托盘天平来称量,只能精确到小数点后一位数字,因此应填: 4.0(写成4扣1分)
(3)溶液的浓度和密度是表示溶液组成的物理里,他们不随体积的改变而改变。
(4)①液体和瓶子都会膨胀,但是液体膨胀的程度大,因此相当于是液体膨胀而瓶子体积不变,因此加的水的量变少,结果偏高;②残留的水对实验结果无影响;③俯视导致加水的量少,结果偏高;④未洗涤烧杯和玻璃棒就直接定容,导致溶质没全部转移进瓶内,结果偏低。
本题难度:一般
4、填空题 铜及其合金是人类最早使用的金属材料。
(1)金属铜采取下列哪种方式堆积( )
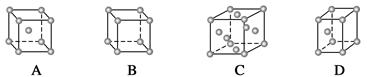
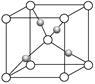
(2)在1个Cu2O晶胞中(结构如上图所示),Cu原子配位数为__________。
(3)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
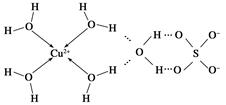
①胆矾的化学式用配合物的形式表示为____________。
②胆矾中SO42—的空间构型为________,H2O中O原子的杂化类型为________。
③某兴趣小组称取2.500 g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图。下列说法正确的是( )
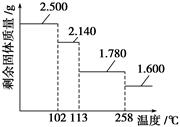
A.晶体从常温升到105 ℃的过程中只有氢键断裂
B.胆矾晶体中形成配位键的4个水分子同时失去
C.120 ℃时,剩余固体的化学式是CuSO4·H2O
D.按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子可以分为3种
参考答案:(1)C (2)2 (3)①[Cu(H2O)4]SO4·H2O ②正四面体形 sp3杂化 ③CD
本题解析:(1)金属Cu采取面心立方堆积,C正确。(2)○为1+8×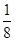 =2, =2, 为4个。所以 为4个。所以 代表Cu原子,○代表氧原子。一个Cu原子周围有2个O原子,所以其配位数为2。(3)在CuSO4晶体中含有4个配位键,配位数为4,所以CuSO4·5H2O用配合物可表示为[Cu(H2O)4]SO4·H2O,SO42—的空间构型为正四面体形,H2O分子中O原子采取sp3杂化。 代表Cu原子,○代表氧原子。一个Cu原子周围有2个O原子,所以其配位数为2。(3)在CuSO4晶体中含有4个配位键,配位数为4,所以CuSO4·5H2O用配合物可表示为[Cu(H2O)4]SO4·H2O,SO42—的空间构型为正四面体形,H2O分子中O原子采取sp3杂化。
n(晶体)=0.01 mol。2.500 g-2.140 g=0.36 g,失去0.02 mol水,所以从常温到105 ℃的过程中除了断裂氢键,还断裂配位键,A错;根据上述分析,B错;C项2.500 g-
1.780 g=0.72 g,失去0.04 mol,所以还剩1个结晶水分子,正确;D项,102~113 ℃失去2个水分子、113~258 ℃,再失去2个水分子,258 ℃以上再失去一个水分子,所以按克服的作用力大小不同,晶体中的水分子可以分为3种,正确。
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数的值,下列说法错误的是
A.在标准状况下22.4L H2中含有氢分子的个数为2NA
B.24g Mg变为Mg2+时失去的电子数为2NA
C.32g O2中含有氧原子的个数为2NA
D.1L 1mol/L NaCl溶液中含有钠离子的个数为NA
参考答案:A
本题解析:A错,在标准状况下22.4L H2中含有氢分子的个数为NA;其他选项正确;
本题难度:一般
|