1、填空题 现有m g某气体,它由四原子分子构成,它的摩尔质量为M g·mol-1。则:
(1)该气体的物质的量为____?____。
(2)该气体中所含的原子总数为________个。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为________。
参考答案:(1) 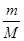 ?mol (2)
?mol (2) 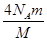 ?(3)
?(3) 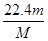 ?(4)
?(4) 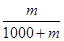 ×100%(每空2分)
×100%(每空2分)
本题解析:(1)物质的量等于质量除以摩尔质量,为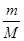 ?mol。
?mol。
(2)该分子为四原子分子,所以该气体中所含的原子总数为: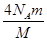 个。
个。
(3)气体的体积等于物质的量乘以摩尔体积,为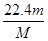 。
。
(4)溶质的质量分数等于溶质的质量除以溶液的质量,为: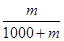 ×100% 。
×100% 。
本题难度:一般
2、选择题 将50 mL 1.0 mol/LNaCl溶液和50mL,0.5 mol/L CaCl2溶液混合后,若溶液的体积变为二者体积之和,则混合液中Cl-的物质的量浓度为
A.1 mol /L
B.0.55 mol /L
C.0.67 mol /L
D.2 mol /L
参考答案:A
本题解析:前者溶液氯离子物质的量为0.05mol,后者溶液氯离子物质的量为0.05mol,则混合液中Cl-的物质的量为0.1mol,混合后溶液体积为100ml,Cl-的物质的量浓度为1 mol /L
故选A
本题难度:一般
3、选择题 向22.4g的Fe2O3、Cu的混合物中加入0.5mol/L的硫酸溶液600mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为 ?
A.6.4g
B.4.8g
C.2.4g
D.1.6g
参考答案:B
本题解析:由题意可知反应后的溶液中溶质为和FeSO4和CuSO4,故Fe2O3和Cu的物质的量之比为1:1其物质的量都为0.1mol,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量应为Fe2O3中O的质量,故减少的质量为0.1×3×16=4.8g,故B正确。
本题难度:一般
4、选择题 NA为阿伏佛加德罗常数,下列叙述正确的是(?)
A.标准状况下,22.4L H2O含有的分子数为NA
B.1 mo1·L-1 NaCl溶液中所含有的Na+离子数目为NA
C.标准状况下,22.4L氯气中所含原子数为NA
D.一定条件下,46克钠与足量的H2O完全反应,转移电子数为2NA
参考答案:D
本题解析:A 错误,标况下,水为液体,不是气体
B?错误,没有给溶液体积,不能求出Na+离子数目
C?错误,标准状况下,22.4L氯气中所含原子数为2NA
D 正确,46克钠为2mol完全反应,失去2mol电子,所以,转移电子数为2NA
本题难度:一般
5、填空题 某核素AZX的氯化物XCl2 1.11g配成溶液后,需用1mol·L-1的硝酸银溶液20ml才能把氯离子完全沉淀下来。则X的质量数为________;若X的核内中子数为20,则37g XCl2中所含质子的物质的量__________。
参考答案:40;18mol
本题解析:
本题难度:一般