1、填空题 (8分)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。回答下列问题:
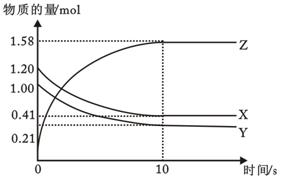
(1)反应开始到10s,用Z表示的反应速率为 ;
(2)反应开始到10s,X的物质的量浓度减少了 ;
(3)反应开始到10s时,Y的转化率为 ;
(4)反应的化学方程式为 。
参考答案:
(1)0.079mol/(L·s) (2)0.395mol/L (3)79% (4)X+Y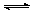 2Z
2Z
本题解析:略
本题难度:简单
2、实验题 甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/?盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
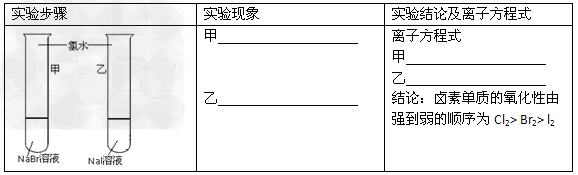
【评价】甲同学设计的实验方案的合理性是___________(填序号)
A.?非常合理 B.?部分合理 C.?完全不合理
【补充和完善】上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂是___________。
(2)探究影响化学反应速率的因素

甲同学所得实验依据和结论有明显问题,问题是__________。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。
①
②电极反应式 ____________________________、____________________________
参考答案:(1) B;溴水
B;溴水
(2)锌粉的表面积大,也能加快反应速率 ?
(3)“略”
本题解析:
本题难度:一般
3、计算题 在一体积为2 L的密闭容器中加入反应物A、B,发生如下反应:
A+2B 3C。反应经2 min后,A的浓度从开始时的1.0 mol/L 降到0.8 mol/L。
3C。反应经2 min后,A的浓度从开始时的1.0 mol/L 降到0.8 mol/L。
已知反应开始时B的浓度是1.2 mol/L。则:
(1)2 min末B的浓度?。
(2) 2 min内 ,用A物质的浓度变化来表示该反应的反应速率,即v(A)=?。
参考答案:(1)0.8 mol ? L?(2)0.1 mol·L-1·min-1?(每空2分,单位错了扣1分)
本题解析:? A?+? 2B? ?3C
?3C
起始浓度(mol/L)? 1.0? 1.2? 0
转化浓度(mol/)? 0.2? 0.4? 0.6
2min后浓度(mol/L)? 0.8? 0.8? 0.6
所以2 min末B的浓度是0.8 mol?L
2 min内 ,用A物质的浓度变化来表示该反应的反应速率v(A)=0.2mol/L÷0.2min=0.1mol/(L·min)
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和检验,难度不大。该类试题需要注意的是在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。
本题难度:一般
4、选择题 在容积固定为4L的密闭容器中,进行了可逆反应:X(g)+2Y(g)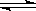 2Z(g) 并达到平衡,在此过程中Y的速率V(Y)与时间t的关系,如图所示,则图中阴影部分的面积可表示
2Z(g) 并达到平衡,在此过程中Y的速率V(Y)与时间t的关系,如图所示,则图中阴影部分的面积可表示
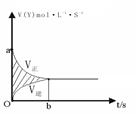
A.X浓度的减少
B.X物质的量的减少
C.Z浓度的增加
D.Y物质的量的减少