|
|
|
高考化学试题《化学反应速率》试题强化练习(2019年最新版)(五)
2019-07-04 01:58:56
【 大 中 小】
|
1、填空题 (12分)在80℃时,将0.40 mol的N2O4气体充入1 L固定容积的密闭容器中发生反应:N2O4  2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据: 2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
时间(s)
| 0
| 20
| 40
| 60
| 80
| 100
| n(N2O?4)(mol)
| 0.40
| a
| 0.20
| c
| d
| e
| n(NO2)(mol)
| 0.00
| 0.24
| b
| 0.52
| 0.60
| 0.60
|
(1)在20s — 40s之间,用N2O4表示的平均反应速率为?。
(2)在80℃时该反应的平衡常数K=?。
(3)要增大该反应的平衡常数,可采取的措施有(填序号)?。
①增大N2O4的起始浓度?②向混合气体中通入NO2
③使用高效催化剂?④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色?(填“变浅”、“变深”或“不变”)。
(5)反应进行至100s后若向容器中再充入0.40 mol的N2O4气体,则达到新平 衡后N2O4的转化率将?(填“增大”、“减小”或“不变”)。 衡后N2O4的转化率将?(填“增大”、“减小”或“不变”)。
2、简答题 锌粒和稀盐酸反应一段时间后,反应速率减慢.此时,加热或加入浓盐酸,该反应速率明显加快.由此判断,影响化学反应速率的因素有( )
①温度?②固体的表面积?③反应物的状态?④溶液的浓度?⑤催化剂.
A.①③
B.②④
C.①④
D.①②③④⑤
3、选择题 关于下列图示的说法中正确的是
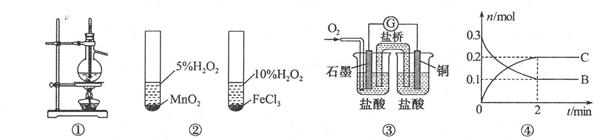
A.图①装置用于分离沸点相差较大的互溶液体混合物
B.图②装置用于研究不同催化剂对反应速率的影响
C.图③中电流计的指针不发生偏转
D.对反应: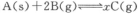 ;根据图④可以求出x=2 ;根据图④可以求出x=2
|
4、填空题 (7分)环境中氮氧化物的合理控制和治理是减少雾霾天气、优化生存环境的有效途径之一。请运用化学反应原理知识,回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+ 4NO2 (g)="==" 4NO(g)+ CO2 (g)+ 2H2O(1) △H1 = -662kJ·mol-1
②CH4 (g)+ 4NO(g) ="==" 2N2 (g)+ CO2 (g)+ 2H2O(1) △H2 =" -1251" kJ·mol-1
据此,写出CH4将NO2还原为N2的热化学方程式:
(2)用活性炭还原法也可处理氮氧化物。有关反应为:C(s)+2NO(g)  N2 (g)+CO2 (g) N2 (g)+CO2 (g)
某研究小组向一个容积(3L)恒定的真空密闭容器中加人0.3mol NO和足量的活性炭与催化剂(固体试样的体积忽略不计),在恒温(T1℃)条件下发生反应,经10min反应达到平衡,测得N2的物质的量为0.09mol。
①0min~10min内以v(NO)表示的平均化学反应速率为 。
②下列各项能判断该反应达到平衡状态的是 。
A.容器内压强保持不变
B.速率关系:2v(NO)(正) =" v" (N2)(逆)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
|
③在相同条件下,若在容器中放入生石灰,则NO的平衡转化率
(填“增大”、“不变”或“减小”)。
5、填空题 (16分)
Ⅰ.可逆反应:A(g)+3B(g) 2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
(1)这时B的浓度为________mol/L,C的浓度为________mol/L。
(2)这段时间内反应的平均速率若以D的浓度变化来表示,应为________mol/(L·min)。
(3)如果保持容器内温度不变,反应前和反应后容器内压强之比为_____(最简整数比)。
Ⅱ.电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液。请回答以下问题:
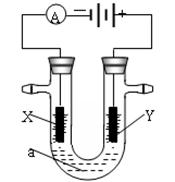
(4)在X极附近观察到的实验现象是:放出气体且______________。检验Y电极反应产物的方法是:把__________________放在Y电极附近,试纸变蓝色。
(5)当通过电解池通过1 mol电子时,两极共收集到________L气体(标准状况),电解池内的液体稀释到500 mL时,NaOH溶液浓度为________mol/L。
 2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。