|
高考化学试题《化学反应速率》试题强化练习(2019年最新版)(四)
2019-07-04 01:58:56
【 大 中 小】
|
1、选择题 恒温密闭容器中,某反应的化学反应速率随时间变化关系如图所示,下列说法不符合该图示的是( )
A.达到平衡时,正逆反应速率相等
B.增大反应物的浓度,反应由平衡I变化到平衡II
C.反应达到平衡I以后,减小反应物浓度,平衡移动到II
D.反应达到平衡II时的化学反应速率比平衡I时的大
| 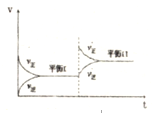
参考答案:A.当正逆反应速率相等时,各物质的浓度不变,达到平衡状态,故A正确;
B.在平衡Ⅰ的基础上正反应速率增大,而逆反应速率在原来基础上逐渐增大,且正反应速率大于逆反应速率,应为增大反应物的浓度,故B正确;
C.如反应物减小,则正逆反应速率都减小,且逆反应速率大于正反应速率,故C错误;
D.由图象可知,纵坐标为反应速率,反应达到平衡II时的化学反应速率比平衡I时的大,故D正确.
故选C.
本题解析:
本题难度:简单
2、填空题 A与B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol.L-1。反应进行2min后,A的浓度为0.8 mol.L-1? ,B的浓度为0.6 mol.L-1 C的浓度为0.6 mol.L-1
(1)2min内反应的平均反应速率为: ν(A)=??
(2)ν(A)、ν(B)、ν(C) 三者之间的关系是:?
(3)该反应的化学反应方程式:?
参考答案:(1)ν(A)=0.1 mol﹒L-1min-1(2)ν(A):ν(B):ν(C)=1:2:3(3)A+2B=3C
本题解析:根据题意,反应进行到2min时A和B的浓度分别减少了0.2mol/L和0.4mol/L,同时生成了0.6mol/L,则根据变化量之比是相应的化学计量数之比可知,该反应的方程式是A+2B=3C。其中2min内反应的平均反应速率为ν(A)=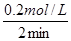 =0.1 mol﹒L-1min-1。因为反应速率之比是相应的化学计量数之比,所以ν(A)、ν(B)、ν(C) 三者之间的关系是ν(A):ν(B):ν(C)=1:2:3。 =0.1 mol﹒L-1min-1。因为反应速率之比是相应的化学计量数之比,所以ν(A)、ν(B)、ν(C) 三者之间的关系是ν(A):ν(B):ν(C)=1:2:3。
点评:该题是基础性试题的考查,主要是考查学生对反应速率含义、计算以及反应速率和化学计量数关系的了解掌握情况,旨在巩固学生的基础,提高学生的应试能力和学习效率。
本题难度:一般
3、选择题 下列条件下的反应,放出H2最快的是:( )
| 金属(粉末状)/mol | 酸的浓度和体积(mL) | 反应温度
①
Mg
0.1
3mol/LH2SO4
10
20℃
②
Al
0.1
3mol/LHCl
10
20℃
③
Zn
0.1
?3mol/LCH3COOH
10
20℃
④
Fe
0.1
6mol/LHNO3
10
20℃
|
A.①
B.②
C.③
D.④
参考答案:因决定化学速率的因素是反应物本身的性质,在上述金属中镁的活泼性最强,金属与酸反应的本质是与氢离子反应,3mol/LH2SO4中氢离子的浓度为6mol/L,3mol/LHCl中氢离子的浓度为3mol/L,3mol/LCH3COOH中氢离子的浓度为远小于3mol/L,6mol/LHNO3中氢离子的浓度为6mol/L,但硝酸与金属反应得不到氢气,故选:A.
本题解析:
本题难度:简单
4、简答题 向一体积不变的密闭容器中加入2mol?A、0.6mol?C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段使用了催化剂;图一中t0~t1阶段c(B)未画出.
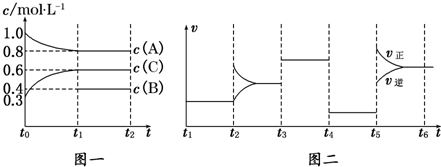
(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=______.
(2)t4~t5阶段改变的条件为______,B的起始物质的量为______.
(3)判断图一中可逆反应达到平衡状态的依据是(填序号)______.
①2v正(A)=3v逆(C)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④A、B、C的浓度都不再发生变化
(4)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a?kJ,写出此温度下该反应的热化学方程式:______.
(5)在相同条件下,若起始时容器中加入a?mol?A、b?mol?B和c?mol?C,要达到t1时刻同样的平衡,a、b、c要满足的条件为______.
参考答案:(1)v=△c△t=0.6mol/L-0.3mol/L15min=0.02?mol/(L?min),故答案为:0.02?mol/(L?min);
(2)结合图一可知,A的变化为0.2mol/L,C的变化量为0.3mol/L,化学反应的速率之比等于化学方程式前的计量系数比,
可写出该反应的方程式为2A(g)+B(g)

3C(g),压强减小,正逆反应速率减小,应反应前后气体的化学计量数之和相等,则改变压强平衡不移动,所以t4~t5阶段改变的条件为减小压强,
B的平衡浓度是0.4mol/L,根据方程式可知,浓度的改变值与化学计量数呈正比,C改变0.3mol/L,则B改变0.1mol/L,
所以起始时应为0.5mol/L,起始2molA所对应的浓度为1mol/L,则体积应是2L,
所以B的起始物质的量为0.5mol/L×2L=1mol,
故答案为:减小压强;?1.0?mol;
(3)①反应达平衡状态时,正逆反应速率相等,则有3v正(A)=2v逆(C),故①错误;
②因气体的质量不变,容器的体积不变,则反应无论是否达到平衡状态,密度都不变,不能作为判断是否达到平衡的依据,故②错误;
③反应前后气体的物质的量不变,质量不变,混合气体的平均相对分子质量不变,不能作为判断是否达到平衡的依据,故③错误;
④当达到平衡状态时,A、B、C的浓度都不再发生变化,可作为平衡状态的判断依据,故④正确,
故答案为:④;
(4)根据方程式计算,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a?kJ,则反应2molA时,交换热量200akJ,而由图象可知,t5~t6阶段应为升高温度,正反应速率大于逆反应速率,平衡向正反应方向移动,则正反应为吸热反应,所以热化学方程式为2A(g)+B(g)?

?3C(g)△H=+200a?kJ/mol,
故答案为:2A(g)+B(g)?

?3C(g)△H=+200a?kJ/mol;
(5)反应的方程式为2A(g)+B(g)?

?3C(g),
根据方程式计算,起始时,将C从理论上转化为A、B,
则A的物质的量为2mol+23×0.6mol=2.4mol,B的物质的量为1mol+13×0.6mol=1.2mol,
在相同条件下,若起始时容器中加入a?mol?A、b?mol?B和c?mol?C,要达到t1时刻同样的平衡,则所加物质的物质的量必须折算后与原平衡相等.
所以有a+2c3=2.4,b+c3=1.2,
故答案为:a+2c3=2.4,b+c3=1.2.
本题解析:
本题难度:一般
5、选择题 现有下列各组溶液:
①10℃时10 mL 0.1 mol·L-1的Na2S2O3溶液和50 mL0.05 mol·L-1的H2SO4溶液;
②10℃时10 mL 0.05 mol·L-1的Na2S2O3溶液和10 mL 0.1 mol·L-1的H2SO4溶液;
③30℃时10 mL 0.05 mol·L-1的Na2S2O3溶液和10 mL 0.1 mol·L-1的H2SO4溶液。
若同时将它们混合发生反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,则出现浑浊的先后顺序是(?)
A.①②③
B.②①③
C.③②①
D.①③②
参考答案:C
本题解析:温度越高,反应速率越快,③的反应速率最大;相同温度下,②混合液中Na2S2O3和H2SO4的浓度大于①,故反应速率②>①。
本题难度:一般
| 