1、填空题 W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1∶1,Y原子最外层s电子与p电子数之比为1∶1,Z原子核外电子中p电子数比Y原子多2个。
(1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式:________________________。
(2)W、X元素的最高价氧化物对应水化物的碱性强弱为__________<__________(用分子式表示)。
(3)这四种元素原子半径的大小为__________>__________>__________>__________(填元素符号)。
参考答案:(1)2Mg+CO2 2MgO+C
2MgO+C
(2)Mg(OH)2<NaOH
(3)Na>Mg>C>O(说明:顺序全对才给分)
本题解析:Y原子最外层s电子与p电子数之比为1∶1,可能为1s22s22p2或1s22s22p63s23p2;X原子核外s电子与p电子数之比为1∶1,可能为1s22s22p4或1s22s22p63s2,考虑到W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y,X、Y应为1s22s22p2、1s22s22p63s2,即分别为镁和碳;Z原子核外电子中p电子数比Y原子多2个,Z为氧元素;W原子的最外层没有p电子,应为钠。同一周期,元素的最高价氧化物对应水化物的碱性减弱,所以,Mg(OH)2<NaOH,元素周期表中的同周期主族元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,因而Na>Mg>C>O。
本题难度:一般
2、填空题 (8分)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:①Cl2→Cl+Cl?②Cl+H2→HCl+H?③H+Cl2→HCl+Cl?……反应②中形成的化合物的 电子式为 ?;反应③中被破坏的化学键属
电子式为 ?;反应③中被破坏的化学键属 于?键(填“极性”或“非极性”)。
于?键(填“极性”或“非极性”)。
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是?(用元素符号表示)。与氯元素同周期且金属性最强的元素 位于周期表的第?
位于周期表的第? ?周期?族。
?周期?族。
( 3)卤素单质及化
3)卤素单质及化 合物在许多性质上都存在着递变规律。下列有关说法正确的是?。
合物在许多性质上都存在着递变规律。下列有关说法正确的是?。
a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
b.卤化氢的键长按H—F、H—C1、H—Br、H—I的顺序依次减小
c.卤化 氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
参考答案:(1)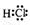 (2分)?非极性(1分)
(2分)?非极性(1分)
(2)S? Cl? F (共2分)。 三(1分)? IA(1分)
(3)a(1分)
本题解析:略
本题难度:一般
3、选择题 下列化合物中阳离子与阴离子的半径比最小的是(?)
A.KI
B.LiF
C.LiI
D.KF
参考答案:C
本题解析:同主族元素自上而下不论是原子半径,还是离子半径均是逐渐增大的,即Li+半径小于K+的,I-半径大于F-的,所以答案是C。
本题难度:简单
4、选择题 下列有关推断中不符合实际的是?
A.第n周期第n族的元素不一定是金属元素
B.第n周期第n族(n>1)的元素一定是金属元素
C.第n周期有(8-n)种非金属元素(n>1,包括稀有气体元素)
D.第n周期中有2n2种元素
参考答案:D
本题解析:D错误,例如第三周期,有8种元素,但根据2n2即有18中元素,所以D不符合实际实际,为本题的正确选项,其他的选项都符合实际。
点评:本题考查了元素周期表,有一定的难度,解答该题的关键采用排除法,不必一一去验证,D选项很明显是错误的。
本题难度:一般
5、选择题 下列叙述正确的是
A.常温常压下,气态非金属单质都是由双原子分子组成的
B.原子晶体中不一定只有共价键
C.醋酸钠和苯酚钠中所含的化学键类型相同
D.所有主族元素的原子形成单原子离子时的最高价数都和它的族序数相等
参考答案:C
本题解析:略
本题难度:一般