1、选择题 下列各组离子,能在水溶液中大量共存的是( )
A.Ba2+、H+、NO3-、OH-
B.Mg2+、H+、Cl-、SO42-
C.Na+、Ca2+、CO32-、SO42-
D.Ca2+、Ag+、OH-、HCO3-
参考答案:A.因H+、OH-结合生成水,不能大量共存,故A错误;
B.因该组离子之间不反应,能大量共存,故B正确;
C.因Ca2+分别与CO32-、SO42-结合生成沉淀,不能大量共存,故C错误;
D.因Ag+、OH-结合生成沉淀,因Ca2+、OH-、HCO3-结合生成沉淀和水,不能大量共存,故D错误;
故选B.
本题解析:
本题难度:简单
2、选择题 下列离子中能使纯水的电离程度减小的是
A.F—
B.HCO3—
C.Cl—
D.HCOOH
参考答案:D
本题解析:要使水的电离程度减小,可以加酸或者加碱,所以应该选择D.另外F-水解,使水电离程度增大,碳酸氢根离子水解也使水的电离程度增大,氯离子不会引起水电离程度的变化.
本题难度:简单
3、选择题 向20 mL NaOH溶液中逐滴加入0.1 mol/L醋酸溶液,滴定曲线如右图所示。下列判断正确的是(?)
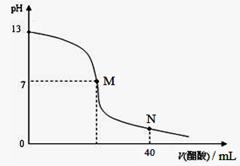
A.在M点,两者恰好反应完全
B.滴定前,酸中c(H+) 等于碱中c(OH-)
C.NaOH溶液的物质的量浓度为0.1 mol/L
D.在N点,c(CH3COO-)>c(Na+)>c(H+)>c(CH3COOH)
参考答案:C
本题解析:醋酸与氢氧化钠恰好反应时,生成的醋酸钠水解,溶液显碱性,M点溶液显中性,A不正确;根据滴定前氢氧化钠的pH可知氢氧化钠的浓度是0.1mol/L,而醋酸是弱酸,溶液中氢离子的浓度小于0.1mol/L,B不正确,C正确;在N点溶液显酸性,则c(CH3COO-)>c(Na+)>c(CH3COOH) >c(H+),D不正确,答案选C。
点评:该题是高考中的常见图像,属于中等难度的试题,试题综合性强,侧重对学生能力的培养与解题方法的指导与训练,有助于培养学生的逻辑推理能力与创新思维能力,也有助于提高学生的应试能力与学习效率。
本题难度:简单
4、选择题 在强酸性溶液中,能大量共存的离子组是 ( )
A.NH4+、Na+、Cl-、SO42-
B.Cu2+、Ca2+、CO32-、Cl-
C.Al3+、 Ag+、NO3-、Cl-
D.K+、HCO3-、Cl-、 Na+