1、选择题 某溶液中只可能含有下列离子中的几种:K+、NH4+、NO3-、SO42-、SO32-、CO32-, 取200mL该溶液分成两等份,进行以下实验:
(1)第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。
(2)第二份先加足量的盐酸无现象,再加足量的BaCl?2,得到2.33g固体,则该溶液中(?)
A.可能含有K+、CO32-
B.一定含有K+且c(K+)≥0.1mol/L
C.一定不含有NO3-
D.肯定含有NO3-、SO42-、NH4+
参考答案:B
本题解析:略
本题难度:简单
2、选择题 某溶液中由水电离生成的c(OH—)=10-12mol/L,则该溶液中一定不能大量共存的离子组是
A.Na+、Mg2+、N03-、SO42—
B.K+、A102-、SO42—、C1-
C.Ba2+、K+、C1-、HS03—
D.Al3+、Cu2+、C1-、SO42—
参考答案:C
本题解析:溶液中由水电离生成的c(OH—)=10-12mol/L,说明溶液中水的电离是被抑制的,所以溶液可能显酸性,也可能显碱性。如果显酸性,则A102-、HS03—不能大量共存。如果溶液显碱性,则Mg2+、Al3+、Cu2+、HS03—不能大量共存。所以溶液中一定不能大量共存的离子组是C,答案选C。
本题难度:一般
3、选择题 某无色透明的溶液,在强碱性的条件下能大量共存的是?
A.Fe2+、K+、NO3―、SO42―
B.NH4+、Mg2+、Cl―、SO42―
C.K+、Na+、NO3―、SO42―
D.Na+、Ba2+、MnO4―、SO42―
参考答案:C
本题解析:A Fe2+是浅绿色
B NH4+在强碱性的条件下不能大量共存
C 可以大量共存
D MnO4―是紫色的
故选C
本题难度:一般
4、选择题 某无色溶液可能由Na2CO3、MgCl2、NaHCO3、BaCl2中的一种或几种混合而成。取少量该溶液加入NaOH溶液出现白色沉淀;另取少量该溶液加入稀H2SO4也出现白色沉淀,并放出气体。据此分析,下述组合判断正确的是: ①肯定有BaCl2? ②肯定有MgCl2? ③肯定有NaHCO3? ④肯定有NaHCO3或Na2CO3? ⑤肯定没有MgCl2
A.①②③
B.①③
C.②④
D.①③⑤
参考答案:B
本题解析:取少量该溶液加入稀H2SO4也出现白色沉淀,并放出气体,这说明生成的白色沉淀应该是硫酸钡,气体是CO2,因此一定含有氯化钡,则不能含有碳酸钠,所以就一定有碳酸氢钠。该溶液加入NaOH溶液出现白色沉淀,则该白色沉淀中一定含有碳酸钡,但也可能含有氢氧化镁沉淀,即氯化镁不能确定,答案选B。
点评:进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。该题的关键是通过硫酸钡沉淀,得出含有氯化钡,进而得出不含有碳酸钠。
本题难度:一般
5、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 NaOH溶液:K+、Na+、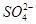 、
、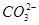
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、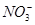 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、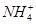 、I-、SCN-
、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、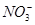
参考答案:A
本题解析:解离子共存问题的关键是确定离子之间是否能发生化学反应。A项,各种离子间不发生反应,能大量共存;B项中会发生反应:Ba2++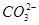 ===BaCO3↓,不能大量共存;C项中会发生反应:2Fe3++2I-===2Fe2++I2和Fe3++3SCN-===Fe(SCN)3,不能大量共存;D项中会发生反应:H++ClO-===HClO,不能大量共存,尤其要注意,c(H+)/c(OH-)=1×1014的溶液应为强酸性溶液。
===BaCO3↓,不能大量共存;C项中会发生反应:2Fe3++2I-===2Fe2++I2和Fe3++3SCN-===Fe(SCN)3,不能大量共存;D项中会发生反应:H++ClO-===HClO,不能大量共存,尤其要注意,c(H+)/c(OH-)=1×1014的溶液应为强酸性溶液。
本题难度:一般