1、填空题 (14分)利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:

试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有?。
(2)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)?。
在实验室中,常将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示)。
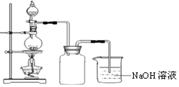
(3)写出烧瓶中发生反应的离子方程式为?
(4)广口瓶的作用是?
(5)为符合绿色化学的要求,某研究性学习小组进行如下
设计:将3.2 g铜丝放到45 mL 1.5 mol·L-1的稀硫酸中,控温在50 ℃。加入18 mL 10%的H2O2,反应0.5h后,升温到60 ℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5 g。请回答:
①加热时温度不宜过高的原因是?;
②本实验CuSO4·5H2O的产率为?。
参考答案:⑴? Fe2O3+6H+=2Fe3++3H2O,2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑;
⑵ 2Cu+O2+2H2SO4=2CuSO4+2H2O 或2Cu+O2=2CuO,CuO+H2SO4=CuSO4+H2O ;
⑶ 3Cu+8H++3NO3-?=3Cu2++2NO↑+4H2O ;
⑷ 安全瓶 ;⑸? ①防止双氧水分解 ;②84% 。
本题解析:(1)铁丝表面有铁锈。投入稀H2SO4中发生反应的两种方程式为:Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+;Fe+2H+=Fe2++H2↑;(2)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是使Cu变为氧化铜,与酸反应得到CuSO4.反应的方程式为:2Cu+O2+2H2SO4=2CuSO4+2H2O 或2Cu+O2=2CuO,CuO+H2SO4=CuSO4+H2O ;(3)在烧瓶中Cu与稀硝酸发生反应的离子方程式为:3Cu+8H++3NO3-?=3Cu2++2NO↑+4H2O ;(4)广口瓶的作用是安全瓶,防止倒吸现象的发生;(5)①加热时温度不宜过高是由于在反应的过程中使用了H2O2,而H2O2受热容易分解,使用温度不宜过高。②n(Cu)=" 3.2" g÷64g/mol=0.05mol,n(H2SO4)=" 0.045" L×1.5 mol/L=" 0.0675" mol硫酸过量,所以产生的CuSO4按照Cu来计算,理论产量:0.05mol×250g/mol=12.5g。因此CuSO4·5H2O的产率为(10.5 g÷12.5g)×100%=84%。
本题难度:一般
2、选择题 将铜片投入到稀硫酸中,铜片不溶,再加入下列试剂后,可使铜片溶解的是(? )
A.稀盐酸
B.硫酸钠晶体
C.硝酸钠晶体
D.氯化铁晶体
参考答案:CD
本题解析:稀盐酸不能溶解铜,硫酸钠也不能溶解铜。在酸性溶液中,硝酸盐具有强氧化性,能把铜氧化,而硝酸则被还原生成NO,C正确。氯化铁中的铁离子能把铜氧化生成铜离子和亚铁离子,D正确。所以答案选CD。
本题难度:一般
3、计算题 (9分)有一铝粉和Fe3O4粉末组成的铝热剂,在隔绝空气的条件下加热使之充分反应。将反应后所得混合物研细,并分成均匀的两等份,在一份中加足量的氢氧化钠溶液,另一份中加入足量的盐酸,反应后,前者消耗m mol NaOH,放出气体0.336 L;后者消耗n mol HCl,放出气体V L,若将等质量的铝热剂直接与足量稀硫酸作用,可得3.36 L气体(上述气体体积均已换算成标准状况)。试求铝热剂中Al的质量分数。
参考答案:28.0%
本题解析:(1)铝热剂直接与H2SO4作用时产生气体的反应如下:
2Al?+? 3 H2SO4?=? Al2(SO4)3?+? 3 H2↑
54.0 g? 67.2 L
m(Al)? 3.36 L
列式可解得:m(Al)=2.70 g
铝热反应后的混合物遇NaOH能放出H2,表明铝热反应Al剩余,则:
2Al + 2NaOH + 6H2O?=? 2Na [Al(HO)4] + 3 H2↑
54.0 g? 67.2 L
m(Al)? 0.336 L
列式可求得:m余(Al)=0.540 g
铝热剂中Fe3O4的质量可求:
3 Fe3O4?+? 8 Al 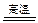 ?4 Al2O3?+? 9 Fe
?4 Al2O3?+? 9 Fe
696 g? 216 g
m(Fe3O4)? 2.70g-0.540g
列式可求得:m(Fe3O4)=6.96 g
则:w(Al)=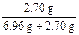 ×100%=28.0%
×100%=28.0%
本题难度:简单
4、选择题 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )

A.1∶1∶1
B.1∶3∶1
C.3∶3∶8
D.1∶1∶4
参考答案:D
本题解析:解答本题应注意以下三点:(1)Fe与Fe(NO3)3、Cu(NO3)2、HNO3反应的先后顺序;(2)横、纵坐标及曲线各折点表示的意义;(3)HNO3反应生成的Fe3+和溶液中的原有Fe3+均与Fe发生反应。
本题难度:一般
5、选择题 下列物质的名称和化学式不相符的是
A.赤铁矿(Fe2O3)
B.硫铁矿(FeS2)
C.铁红(Fe2O3)
D.磁铁矿(FeO)
参考答案:D
本题解析:略
本题难度:简单