1、选择题 25 ℃下Ksp[Mg(OH)2]=5.6110-12 ,Ksp(MgF2)=7.4210-11 。下列说法正确的是
A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的C(Mg2+)大
B.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,C(Mg2+)增大
C.25 ℃时,Mg(OH)2固体在20 mL 0.01 molL-1氨水中的Ksp比在20 mL 0.01molL-1NH4Cl溶液中的Ksp小
D.25 ℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
参考答案:B
本题解析:
A. Ksp[Mg(OH)2]=5.61*10-12,Ksp(MgF2)=7.42*10-11由此可知,MgF2的Ksp比较大,溶解度比较大,饱和溶液中的镁离子浓度也比较大。
B. 氯化铵固体溶于水后,由于铵根离子水解结合氢氧根,使溶液中氢氧根离子浓度减小,
Mg(OH)2可逆电离出镁离子和氢氧根离子,由于氢氧根离子浓度减小,平衡向正反应方向移动,也就是向沉淀溶解的方向移动,这样镁离子浓度就增大了。
C. Ksp是平衡常数的一种,只受温度影响,不同溶液中虽然氢氧根离子浓度不同,但是温度都是25度,所以Ksp不变。
D. Mg(OH)2悬浊液中镁离子浓度有一定的数值,虽然MgF2更难溶,但是只要加入的氟离子浓度足够大,也可以使[Mg2+]*[F-]2>Ksp(MgF2),实现Mg(OH)2转化为MgF2
本题难度:一般
2、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是(?)
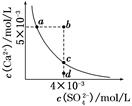
A.在任何溶液中,c(Ca2+)、c(SO42-)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
参考答案:C
本题解析:A项只有在单一CaSO4溶液中c(Ca2+)、c(SO42-)才相等,A项错误;B项b点Qc>Ksp,故有沉淀生成,开始c(Ca2+)、c(SO42-)不相等而反应消耗的Ca2+、SO42-相等,因此平衡后的两种离子也不会都等于3×10-3 mol/L,B项错误;在平衡线上的Ksp均相等,C项正确;D项d点通过蒸发后各离子浓度都增大,不可能保持SO42-浓度不变而到达c点,D项错误。
本题难度:一般
3、实验题 (14分)
氢溴酸在工业和医药领域中有着广泛的用途,下图是某兴趣小组模拟工厂制备氢溴酸粗品并精制的流程如下:
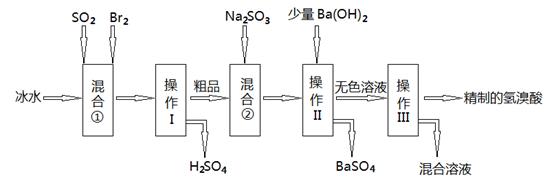
(1)混合①使用冰水的目的是 ;
(2)操作II和III的名称是 , ;
(3)混合②中发生反应的离子方程式为 ;
(4)工业上用氢溴酸和大理石制得溴化钙中含有少量Al3+、Fe3+杂质,加入适量的试剂 (填化学式)后控制溶液的PH约为8.0即可除去杂质,控制溶液的PH约为8.0的目的是_______________________________________________________;
(5)t℃时,将HBr通入AgNO3溶液中生成的AgBr在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgCl的Ksp=4×l0-10,下列说法不正确的是 ( )
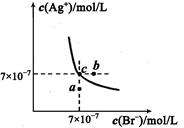
A.向含有Cl-和Br- 的混合液中滴加硝酸银溶液,一定先产生AgBr的沉淀
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数Κ≈816
AgBr(s)+Cl-(aq)平衡常数Κ≈816