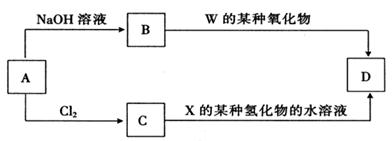
1、选择题 在一定温度下,硫酸铜晶体的培养皿中存在下列平衡:Cu2+(aq)+SO42-(aq)+xH2O?CuSO4?xH2O(s),当向饱和硫酸铜溶液中加少量无水硫酸铜粉末后,下列说法中正确的是( )
A.溶液中Cu2+浓度增大
B.溶液中Cu2+数目减少
C.该硫酸铜晶体质量不变
D.溶液的蓝色变浅
参考答案:在饱和硫酸铜溶液中加入无水硫酸铜粉末,发生:CuSO4+xH2O=CuSO4?xH2O,导致溶液中水的量减少,会导致平衡:
Cu2+(aq)+SO42-(aq)+xH2O?CuSO4?xH2O(s)向正方向移动,则析出晶体后溶液仍为饱和溶液,则
A.仍为饱和溶液,则溶液中Cu2+浓度不变,故A错误;
B.Cu2+(aq)+SO42-(aq)+xH2O?CuSO4?xH2O(s)向正方向移动,溶液中Cu2+数目减少,故B正确;
C.Cu2+(aq)+SO42-(aq)+xH2O?CuSO4?xH2O(s)向正方向移动,析出晶体,硫酸铜质量增大,故C错误;
D.溶液浓度不变,则溶液颜色不变,故D错误.
故选B.
本题解析:
本题难度:简单
2、填空题 (12分)皮革工业污泥中含较多的Cr,工业采用以下工艺制得M[Cr(OH)(H2O)5SO4]。
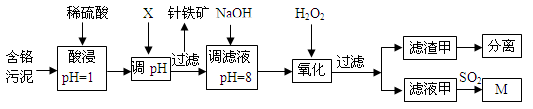
已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+。
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
阳离子
| Fe3+
| Al3+
| Cu2+
| Mg2+
| Cr3+
|
开始沉淀时的pH
| 1.9
| 3.7
| 4.7
| 9.3
| ---
|
沉淀完全时的pH
| 3.2
| 8.0
| 6.7
| 11.1
| 9(>9溶解)
|
(1)酸浸时,为了提高浸取效率可采取的措施是________________(任写一条)。
(2)调节pH所用X可以选用 。
A.NaOH B.Na2CO3 C.H2SO4 D.HNO3
(3)加入H2O2 目的是把Cr(OH)3沉淀转化为Cr2O72-,写出该反应的离子方程式 。针铁矿组成元素是Fe、H、O,化学式量为89,其化学式是______________。
(4)调滤液至pH=8,Al3+、Cu2+、Mg2+中的_________将转化为沉淀。
(5)若滤液甲的pH=a,则溶液中c (Cu2+)= 。(25℃时的Ksp[ Cu(OH)2]=2.2×10-20)
参考答案:(1)升温或搅拌或多次浸取货适当延长酸浸时间或适当提高酸的浓度等。
(2)AB
(3)2Cr(OH)3+2H2O2+2OH—=Cr2O72—+7H2O Fe0(OH)
(4)Al3+、Cu2+
(5)2.2×108-2amol/L
本题解析:(1)酸浸时,为了提高浸取效率,可改变条件为温度、浓度、接触面积、接触时间等,故采取的措施是升温或搅拌或多次浸取货适当延长酸浸时间或适当提高酸的浓度等;(2)加入X调节pH升高目的是为了使Fe3+形成沉淀,故可用试剂为NaOH或Na2CO3,故选AB;(3)加入H2O2 目的是把Cr(OH)3沉淀转化为Cr2O72-,写出该反应的离子方程式2Cr(OH)3+2H2O2+2OH—=Cr2O72—+7H2O;针铁矿组成元素是Fe、H、O,化学式量为89,其化学式是Fe0(OH);由图表可知调滤液至pH=8,Al3+、Cu2+、Mg2+中的Al3+、Cu2+均转化为沉淀;(5)若滤液甲的pH=a,则溶液中c (Cu2+)= =2.2×108-2amol/L。
=2.2×108-2amol/L。
考点:化学工艺流程。
本题难度:困难
3、填空题 (10分)短周期元素W、X、Y、Z在元素周期表中的位置如图所示。
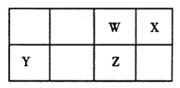
其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
(1)W在元素周期表中的位置是 。
(2)Z的原子结构示意图为 。
(3)下列选项中,能证明元素非金属性X强于W的是 。
A.原子序数:X>W
B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W
D.最高价氧化物的水化物酸性:X>W