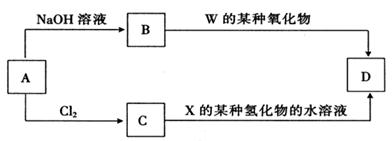
1、选择题 在一定温度下,硫酸铜晶体的培养皿中存在下列平衡:Cu2+(aq)+SO42-(aq)+xH2O?CuSO4?xH2O(s),当向饱和硫酸铜溶液中加少量无水硫酸铜粉末后,下列说法中正确的是( )
A.溶液中Cu2+浓度增大
B.溶液中Cu2+数目减少
C.该硫酸铜晶体质量不变
D.溶液的蓝色变浅
2、填空题 (12分)皮革工业污泥中含较多的Cr,工业采用以下工艺制得M[Cr(OH)(H2O)5SO4]。
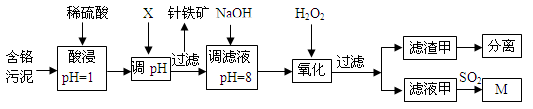
已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+。
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
阳离子
| Fe3+
| Al3+
| Cu2+
| Mg2+
| Cr3+
|
开始沉淀时的pH
| 1.9
| 3.7
| 4.7
| 9.3
| ---
|
沉淀完全时的pH
| 3.2
| 8.0
| 6.7
| 11.1
| 9(>9溶解)
|
(1)酸浸时,为了提高浸取效率可采取的措施是________________(任写一条)。
(2)调节pH所用X可以选用 。
A.NaOH B.Na2CO3 C.H2SO4 D.HNO3
(3)加入H2O2 目的是把Cr(OH)3沉淀转化为Cr2O72-,写出该反应的离子方程式 。针铁矿组成元素是Fe、H、O,化学式量为89,其化学式是______________。
(4)调滤液至pH=8,Al3+、Cu2+、Mg2+中的_________将转化为沉淀。
(5)若滤液甲的pH=a,则溶液中c (Cu2+)= 。(25℃时的Ksp[ Cu(OH)2]=2.2×10-20)
3、填空题 (10分)短周期元素W、X、Y、Z在元素周期表中的位置如图所示。
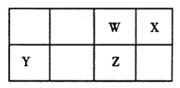
其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
(1)W在元素周期表中的位置是 。
(2)Z的原子结构示意图为 。
(3)下列选项中,能证明元素非金属性X强于W的是 。
A.原子序数:X>W
B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W
D.最高价氧化物的水化物酸性:X>W