1、选择题 已知反应mA(g)+nB(g) qD(g)的△H<0,m+n>q,在一个体积固定的密闭容器中反应达到平衡时,下列说法正确的是
qD(g)的△H<0,m+n>q,在一个体积固定的密闭容器中反应达到平衡时,下列说法正确的是
A.增加A的质量,B的转化率降低
B.降低温度,混合气体的平均相对分子质量变小
C.通入稀有气体压强增大,平衡向正反应方向移动
D.B的正反应速率是A的逆反应速率的n/m
参考答案:D
本题解析:A是气体,增加A的质量,则平衡向正反应方向移动,B的转化率增大,A不正确;正反应是放热反应,所以降低温度,平衡向正反应方向移动。又因为正反应是体积减小的,所以混合气体的平均相对分子质量变大,B不正确;通入稀有气体压强增大,但物质的浓度不变,平衡不移动,C不正确;根据反应速率在之比是相应的化学计量数之比可知,D正确,答案选D。
本题难度:一般
2、选择题 一定温度下,反应N2(g)+3H2(g) 2NH3(g)的反应热和化学平衡常数分别为△H和K, 则相同温度时反应4NH3(g)
2NH3(g)的反应热和化学平衡常数分别为△H和K, 则相同温度时反应4NH3(g) 2N2(g)+6H2(g)反应热和化学平衡常数为(? )
2N2(g)+6H2(g)反应热和化学平衡常数为(? )
A.2△H和2K
B.-2△H和 K2
C.-2△H和 K-2
D.2△H和-2K
参考答案:C
本题解析:反应热和化学计量数成之比,即反应热是-2△H;平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,选项C正确,答案选C。
本题难度:简单
3、计算题 (18分)(1)1 mol O2与足量氢气反应产生水蒸气放热483.6 kJ,若1 g水蒸气转化成液态水放热2.444 kJ,请写出表示氢气燃烧热的热化学方程式:__________________________________。
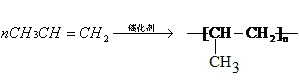
(2)由汽油裂解得到乙烯、丙烯是重要的化工原料,请写出下列转化的方程式,并注明反应类型。
丙烯? → 聚丙烯
___________________________________________________?
(3)将N2、H2置于容积为2L的密闭容器中,发生反应,反应进行到4S末,测得N2 2mol 、H21.5mol、NH32mol。则用氮气浓度的减少来表示该反应速率为__________ 。
(4)在500ml密闭容器中,将2mol A和1molB混合加热到500℃,达到平衡
2 A(g) +B (g) 3C(g)?K = 16求A转化为C的转化率为__________。
3C(g)?K = 16求A转化为C的转化率为__________。
(5) 在密闭容器中发生下列反应:aA(g)  cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,A的浓度为原平衡的2.1倍,则 a? _______ c+d(填“>”、“=”或“<”)。
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,A的浓度为原平衡的2.1倍,则 a? _______ c+d(填“>”、“=”或“<”)。
(6) 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,反应的化学方程式为______________________________________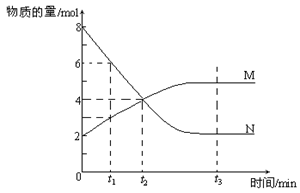
参考答案:H2(g)+1/2O2(g)===H2O(l)?ΔH=-285.8 kJ·mol-1
0.125mol/(L.S)? 57.1%? <? 2N M
M
本题解析:(1)燃烧热是指再一定条件下,1mol可燃物完全燃烧,生成稳定的氧化物时所放出的热量,根据题意可知,1mol氢气完全燃烧生成水蒸气时放出的热量是483.6 kJ÷2=241.8 kJ。又因为1 g水蒸气转化成液态水放热2.444 kJ,所以18g水蒸气转化为液态水放出的热量是2.444 kJ×18=44kJ,所以氢气的燃烧热是(241.8+44)kJ/mol,则相应的热化学方程式为H2(g)+1/2O2(g)===H2O(l)?ΔH=-285.8 kJ·mol-1。
(2)丙烯中含有碳碳双键,能发生加聚反应,方程式为 。
。
(3)生成氨气是2mol,则消耗氮气是1mol,所以氮气的反应速率是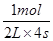 =0.125mol/(L.S)。
=0.125mol/(L.S)。
(4)? 2 A(g) +B (g) 3C(g)?
3C(g)?
起始浓度(mol/L)? 4? 2? 0
转化浓度(mol/L)? 2x? x? 3x
平衡浓度(mol/L)? 4-2x? 2-x? 3x
所以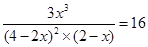
解得x=1.142
因此转化率是1.142÷4×100%=57.1%。
(5)将气体体积压缩到原来的一半的瞬间,A的浓度为原平衡的2倍,但平衡时A的浓度为原平衡的2.1倍,说明增大压强平衡向逆反应方向移动,所以a小于 c+d。
(6)根据图像可知,反应进行到t1时,N减少了2mol,M增加1mol,所以根据变化量之比是相应的化学计量数之比可知,方程式为2N M。
M。
本题难度:一般
4、填空题 (6分)某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
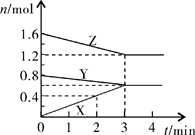
(1)该反应的化学方程式:?;
(2)0~2min末,X的平均反应速率为?mol·L-1·min-1;
(3)3min后图中曲线所表示的含义是?
?。
参考答案:(1)Y(g)+2Z(g) 3X(g)(2)0.1(3)反应已达到平衡。?(2×3=6分)
3X(g)(2)0.1(3)反应已达到平衡。?(2×3=6分)
本题解析:(1)根据图像可知,反应进行到3min时,Z和Y的物质的量分别减少0.4mol、0.2mol,X的物质的量增加0.6mol。所以根据变化量之比是相应的化学计量数之比可知,方程式为Y(g)+2Z(g) 3X(g)。
3X(g)。
(2)反应速率通常用单位时间内浓度的变化量来表示,所以0~2min末,X的平均反应速率为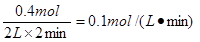 。
。
(3)根据图像可知,3min后物质的浓度不再发生变化,所以反应达到平衡状态。
本题难度:一般
5、选择题 有mA(g)+nB(g)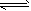 pC(g)+qD(g)反应,经10 min达到平衡,结果A的浓度减少了
pC(g)+qD(g)反应,经10 min达到平衡,结果A的浓度减少了 ,B的浓度减少了
,B的浓度减少了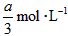 ,C的浓度增加了
,C的浓度增加了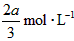 ,然后增大容器容积,A、B、C的体积分数不变,则m∶n∶p∶q为
,然后增大容器容积,A、B、C的体积分数不变,则m∶n∶p∶q为
[? ]
A.1∶3∶2∶2
B.2∶3∶3∶2
C.1∶3∶2∶1
D.3∶1∶2∶2
参考答案:D
本题解析:
本题难度:一般