1、选择题 向CH3COOH?CH3COO-+H+的平衡体系中,加入少量下列物质能使醋酸的电离程度和溶液的pH都变小的是( )
A.H2O
B.CH3COONa
C.NH3?H2O
D.H2SO4
参考答案:A.向醋酸中加入少量水,促进醋酸电离,则醋酸的电离程度增大,故A错误;
B.向醋酸中加入醋酸钠固体,醋酸钠溶于水电离出醋酸根离子,抑制醋酸电离,醋酸的电离程度减小,且溶液的pH增大,故B错误;
C.向醋酸中加入氨水,氨水和氢离子反应,促进醋酸电离,且溶液的pH增大,故C错误;
D.向醋酸溶液中加入硫酸,氢离子浓度增大,溶液的pH减小,同时抑制醋酸电离,醋酸的电离程度减小,故D正确;
故选D.
本题解析:
本题难度:简单
2、选择题 相同温度下,两种氨水A、B,浓度分别是0.2 mol/L和0.1 mol/L,则A和B的OH-浓度之比
[? ]
A.大于2
B.小于2
C.等于2
D.不能确定
参考答案:B
本题解析:
本题难度:一般
3、选择题 25℃ 时,水的离子积为Kw,该温度下将 a mol ·L-1一元酸 HA 与b mol·L-1一元强碱BOH 等体积混合,若恰好完全反应,下列结论中不正确的是
A. 混合液中:c(H+ ) ≤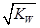 ?B. 混合液中:c(HA)+c(A-)=a mol·L-1?
?B. 混合液中:c(HA)+c(A-)=a mol·L-1?
C.? a = b?D. 混合液中:c(H+)+c(B+)= c(OH-)+c(A-)
参考答案:B
本题解析: HA 与BOH 等体积混合,恰好完全反应:HA+BOH==BA+H2O,酸和碱的物质的量相同,故C正确;根据电荷守恒,D正确;若HA为强酸,反应后的盐溶液为中性,c(H+)=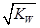 ;若HA为若酸,反应后的盐溶液为碱性,c(H+)<
;若HA为若酸,反应后的盐溶液为碱性,c(H+)<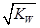 ,A正确;若HA为强酸,反应后的盐溶液为中性,c(A-)=1/2a mol·L-1;若HA为若酸,反应后的盐溶液为碱性,c(HA)+c(A-)=1/2a mol·L-1,B不正确;
,A正确;若HA为强酸,反应后的盐溶液为中性,c(A-)=1/2a mol·L-1;若HA为若酸,反应后的盐溶液为碱性,c(HA)+c(A-)=1/2a mol·L-1,B不正确;
本题难度:一般
4、选择题 25℃时,弱酸的电离平衡常数如下表,下列表述错误的是
弱酸
| CH3COOH
| HCN
| H2CO3
|
K
| 1.8×10-5
| 4.9×10-10
| K1=4.3×10-7 K2=5.6×10-11
|
A.CN-+H2O+CO2→HCN+HCO3-
B.相同温度时三种浓度相同溶液,pH关系:Na2CO3> NaCN > CH3COONa
C.等体积、等物质的量浓度的CH3COOH和Na2CO3混合反应后:
c(Na+)>c(HCO3-)>c(CH3COO-)>c(OH-)>c(H+)
D.amol/L HCN与bmol/L NaOH等体积混合溶液c(Na+)>c(CN-),则a一定小于b
参考答案:CD
本题解析:A、碳酸酸性强于HCN ,但HCO3-酸性弱于HCN,正确;B、三种物质对应酸及强弱为为HCO3-<HCN <CH3COOH,其水解程度为Na2CO3> NaCN > CH3COONa,水解程度越大,碱性越强,正确;C、生成等浓度的醋酸钠和碳酸氢钠混合溶液,醋酸酸性强于碳酸,故碳酸氢钠水解程度大于醋酸钠,故有c(Na+)> c(CH3COO-) > c(HCO3-) >c(OH-)>c(H+),错误;D、两者恰好反应时生成NaCN,水解CN-使得c(Na+)>c(CN-),若碱过量同样有c(Na+)>c(CN-),即a≤b,错误。
考点:考查溶液中离子浓度关系有关问题。
本题难度:一般
5、选择题 H2SO3、H2CO3分别属于中强酸和弱酸,H2SO3 ?H+ + HSO3-? HSO3-
?H+ + HSO3-? HSO3- ?H+ + SO32-? H2CO3
?H+ + SO32-? H2CO3 ?H+ + HCO3-;HCO3-
?H+ + HCO3-;HCO3- ?H+ + CO32-;已知K1 > K1" ≈ K2 > K2",则溶液中不可以大量共存的离子组合是(?)
?H+ + CO32-;已知K1 > K1" ≈ K2 > K2",则溶液中不可以大量共存的离子组合是(?)
A.SO32-、HCO3-
B.HSO3-、CO32-
C. SO32-、CO32-
D.HSO3-、HCO3-
参考答案:B
本题解析:略
本题难度:简单