|
|
|
高中化学知识点总结《弱电解质电离平衡》考点特训(2019年冲刺版)(六)
2020-07-07 22:57:07
【 大 中 小】
|
1、选择题 下列叙述中,不正确的是
A.pH=2与pH=1的CH3COOH溶液中,c(H+)之比为1 :10
B.1.0mol/ L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
C.仅含Na+、H+、OH-、CH3COO-离子的某溶液中可能存在:
c(Na+)>c(CH3COO-) >c(OH-)>c(H+)
D.0.1mol/ L的CH3COOH溶液中,由水电离出的c(H+)为1×10-13mol/ L
参考答案:D
本题解析:A、pH=2与pH=1的CH3COOH溶液中,c(H+)分别为0.01mol/L、0.1mol/L,所以c(H+)之比为1 :10,正确;B、根据质子守恒规律,水电离产生的H+与CO32-结合生成HCO3-和H2CO3,而水电离产生的H+与OH-浓度相等,所以c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),正确;C、仅含Na+、H+、OH-、CH3COO-离子的某溶液可能是醋酸钠溶液,所以不水解的离子的浓度最大,其次是水解离子,再次是显性离子,最后是不显性离子,醋酸钠溶液显碱性,所以c(Na+)>c(CH3COO-) >c(OH-)>c(H+),正确;D、CH3COOH为弱酸,在水溶液中部分电离,所以0.1mol/ L的CH3COOH溶液中的c(H+) ≠0.1mol/L,则由水电离出的c(H+) ≠1×10-13mol/ L,错误,答案选D。
本题难度:一般
2、选择题 下列有关说法正确的是
A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0
B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反
C.加热0.1mol·L-1FeCl3溶液,Fe3+的水解程度增大、溶液的pH减小
D.向0.1mol·L-1CH3COOH溶液中加水,则c(H+)与c(CH3COOH)的比值减小
|
参考答案:C
本题解析:A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,由于正反应是熵变增大的,则根据△G=△H—T·△S可知该反应的ΔH>0,A错误;B.金属性是Zn>Fe>Sn,则镀锌铁制品镀层破损后,铁制品熔融不会腐蚀,但镀锡铁则相反,因为此时铁是负极,失去电子,加快腐蚀,B错误;C.水解吸热,加热0.1mol·L-1FeCl3溶液,Fe3+的水解程度增大、溶液的pH减小,C正确;D.醋酸是弱电解质存在电离平衡,向0.1mol·L-1CH3COOH溶液中加水促进电离,氢离子浓度减小,但氢离子个数增加,所以c(H+)与c(CH3COOH)的比值增大,D错误,答案选C。
考点:考查反应自发性、金属腐蚀、水解以及电离平衡等
本题难度:一般
3、选择题 下列说法中,正确的是
A.0.l mol/L醋酸钙溶液中,c(Ca2+)>c(CH3COO-)>c(OH-)>c(H+)
B.等体积等pH的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少
C.将n mol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者
D.某物质的溶液中由水电离出的c(H+)=1×10-a mol·L-1,若a>7时,则该溶液的pH一定为14-a
参考答案:B
本题解析:A错,c(CH3COO-)>c(Ca2+)>c(OH-)>c(H+)
B正确,.等体积等pH的NH4Cl溶液、盐酸溶液中氢离子的物质的量相同,加入锌粉后,随着反应的不断进行,铵根离子不断水解,继续产生氢离子,所以完全溶解少量且等同的锌粉,前者用时少;
C错,H2(g)+ I2(g)?2HI2(g)的反应为可逆反应,恒温恒容的条件下,n mol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率相等。
D错,某物质的溶液中由水电离出的c(H+)=1×10-a mol·L-1,若a>7,即抵制水的电离,该溶液可能是酸、可能是碱,则溶液的pH可能为a,可能为14-a
本题难度:一般
4、选择题 下列实验事实不能证明醋酸是弱酸的是
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,测得0.1 mol/L醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
|
参考答案:D
本题解析:A.常温下,测得醋酸钠溶液的pH>7,说明醋酸钠为强碱弱酸盐,水解呈碱性,可证明醋酸为弱酸,故A不选;B.常温下,测得0.1 mol/L醋酸溶液的pH=4,说明醋酸没有完全电离,可证明醋酸为弱酸,故B不选;C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4,说明加水稀释促进电离,如为强酸,稀释后pH=4,可证明为弱酸,故C不选;D.醋酸为一元酸,氢氧化钠为一元碱,二者恰好反应,不能证明醋酸为弱酸,故选D.
考点:弱电解质
本题难度:一般
5、选择题 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。
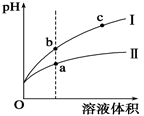
据图判断正确的是
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点酸的总浓度大于a点酸的总浓度
C.a点Kw的数值比c点Kw的数值大
D.b点溶液的导电性比c点溶液的导电性强
参考答案:D
本题解析:
试题分析: A由于弱酸存在电离平衡,相同pH、相同体积的盐酸和醋酸溶液分别加水稀释时,醋酸的酸性降低的相对慢一些,从图像可知I线表示盐酸稀释,II线表示醋酸稀释,A错误;B. 由于两酸的PH相同,盐酸的浓度小,稀释相同倍数,仍然是醋酸的浓度大于盐酸,C错误; C:温度相同的情况下,KW是定值,C错误;D.b点溶液稀释后可变成c点溶液,c点溶液中离子浓度小,导电性差,D正确;选D。
考点:考查弱电解质的电离。
本题难度:一般
